Evaluación de especímenes de tejido placentario y fetal para detectar infección por el virus del Zika - 50 estados y Distrito de Columbia, enero - diciembre, 2016
Semanal / 23 de junio del 2017 / 66(24);636-643
Datos del artículo
Las vistas equivalen a las vistas de páginas más las descargas de PDFVistas:
Citas:
Métricas alternativas:
Detalles de la métricaSarah Reagan-Steiner, MD1; Regina Simeone, MPH2; Elizabeth Simon, MPH2; Julu Bhatnagar, PhD1; Titilope Oduyebo, MD3; Rebecca Free, MD4; Amy M. Denison, PhD1; Demi B. Rabeneck, MS1; Sascha Ellington, MSPH2; Emily Petersen, MD2; Joy Gary, DVM1; Gillian Hale, MD1; M. Kelly Keating, DVM1; Roosecelis B. Martines, MD1; Atis Muehlenbachs, MD1; Jana Ritter, DVM1; Ellen Lee, MD5; Alexander Davidson, MPH5; Erin Conners, PhD5; Sarah Scotland, MPH6; Kayleigh Sandhu, MPH6; Andrea Bingham, PhD7; Elizabeth Kassens7; Lou Smith, MD8; Kirsten St. George, MD8; Nina Ahmad, MD8; Mary Tanner, MD9,10; Suzanne Beavers, MD11; Brooke Miers, MS1,12; Kelley VanMaldeghem, MPH2; Sumaiya Khan, MPH2; Ingrid Rabe, MBChB13; Carolyn Gould, MD13; Dana Meaney-Delman, MD14; Margaret A. Honein, PhD2; Wun-Ju Shieh, MD1; Denise J. Jamieson, MD3; Marc Fischer, MD13; Sherif R. Zaki, MD1; Colaboración con el Registro de Casos de Zika en el Embarazo en los EE. UU.; Equipo de patología, Grupo operativo de epidemiología y vigilancia en respuesta ante el virus del Zika (ver las afiliaciones de los autores)
Ver la referencia bibliográfica sugeridaResumen
¿Qué se sabe sobre este tema?
La infección por el virus del Zika durante el embarazo puede causar microcefalia y otras anomalías en el cerebro. El diagnóstico de la infección por el virus del Zika es difícil debido a la reactividad serológica cruzada con otros flavivirus relacionados y a la duración limitada del período de viremia. El ARN del virus del Zika puede ser detectado en los tejidos placentarios y fetales, lo que puede proporcionar una oportunidad de diagnosticar la infección materna por el virus del Zika y se puede considerar cuando las pruebas serológicas de la madre no son definitivas o cuando dan un resultado negativo fuera de la ventana óptima para las pruebas.
¿Qué información agrega este informe?
En los 50 estados de EE. UU. y el Distrito de Columbia, las pruebas a la placenta proporcionaron un diagnóstico confirmado de infección materna por el virus del Zika reciente en un 10% de los bebés nacidos vivos con posible exposición materna al virus del Zika que no contaban con evidencia definitiva de infección materna o congénita por el virus del Zika. Esto incluyó embarazos con evidencia clínica o de laboratorio de infección materna reciente por flavivirus no específico, y aquellos con IgM negativo del virus del Zika en la madre en casos donde se produjo una posible exposición materna unas >;12 semanas antes de la obtención del suero.
¿Cuáles son las consecuencias para la práctica de salud pública?
Las pruebas a los tejidos placentarios de nacimientos vivos produjeron evidencia definitiva de infección materna por el virus del Zika. Si bien la proporción de bebés nacidos vivos para los cuales el tejido placentario dio un resultado positivo por RT-PCR para el virus del Zika fue relativamente baja, la prueba a los tejidos placentarios de nacimientos vivos puede seguir siendo una opción cuando los resultados de las pruebas para detectar el virus del Zika en la madre no son definitivas o no se realizan dentro del período óptimo. Garantizar las pruebas adecuadas para detectar el virus del Zika y el seguimiento clínico de los bebés, según las directrices publicadas por los CDC es clave para identificar la infección congénita por el virus del Zika.
La infección por el virus del Zika durante el embarazo puede causar microcefalia congénita y anomalías cerebrales (1), y la detección de ARN del virus del Zika en especímenes clínicos y de tejidos puede proporcionar evidencia de laboratorio definitiva de una infección por el virus del Zika reciente. Si bien la duración de la viremia suele ser breve, se ha reportado ARN del virus del Zika detectable por un periodo prolongado en tejidos placentarios, fetales y del cerebro del recién nacido, lo que puede proporcionar información clave de diagnóstico al confirmar una infección reciente por el virus del Zika (2). De acuerdo con las directrices recientes (3,4), los CDC indican pruebas del virus del Zika en tejidos placentarios y fetales en situaciones clínicas donde esta información podría ser valiosa para el diagnóstico. Este informe describe la evaluación de especímenes de tejidos embebidos en parafina y fijados en formol (FFPE, por sus siglas en inglés) a los que se realizaron pruebas para detectar la infección por el virus del Zika en 2016 y la contribución de dichas pruebas a la respuesta de salud pública. Among 546 live births with possible maternal Zika virus exposure, for which placental tissues were submitted by the 50 states and District of Columbia (DC), 60 (11%) were positive by Zika virus reverse transcription–polymerase chain reaction (RT-PCR). De entre 81 pérdidas de embarazos para los cuales se presentaron tejidos placentarios y/o fetales, 18 (22%) dieron un resultado positivo por RT-PCR para el virus del Zika. La RT-PCR para el virus del Zika fue positiva en tejidos placentarios de 38/363 (10%) nacimientos vivos con evidencia serológica materna de infección reciente por flavivirus no específico y de 9/86 (10%) con inmunoglobulina M (IgM) del virus del Zika negativa en la madre en casos con posible exposición materna >;12 semanas antes de la obtención del suero. Estos resultados demuestran que las pruebas de RT-PCR del virus del Zika a especímenes de tejidos pueden proporcionar un diagnóstico confirmado de infección materna reciente por el virus del Zika.
La RT-PCR del virus del Zika y, en ciertos casos, las pruebas inmunohistoquímicas (IHC), se realizaron en la División de Patología de Enfermedades Infecciosas (IDPB) de los CDC sobre los especímenes de tejidos FFPE presentados de embarazos completados (es decir, nacimientos vivos y pérdidas de embarazos en cualquier edad gestacional) con posible exposición materna al virus del Zika.* Los embarazos completados que forman parte de este informe incluyen aquellos con evidencia de posible infección reciente por el virus del Zika (de especímenes de la madre, el feto o el bebé) y aquellos que finalmente no presentaron evidencia comprobada en laboratorio de posible infección por el virus del Zika. Para determinar el valor de diagnóstico adicional de las pruebas de RT-PCR en tejidos para el virus del Zika, los resultados de muestras clínicas que no fueran de tejidos (es decir, suero y/u orina) reportados por el departamento de salud correspondiente o la Subdivisión de Enfermedades Arbovirales de los CDC, se categorizaron según los resultados de las pruebas maternas (Tabla 1) (5) y resultados de pruebas a los bebés.† Los resultados de la RT-PCR en tejidos también se resumen por estados de los síntomas maternos y trimestre de la infección o posible exposición.§ Un subgrupo de embarazos que también se reportaron al Registro de Casos de Zika en el Embarazo en los EE. UU. (USZPR)¶ fue revisado sistemáticamente para determinar la presencia de posibles defectos de nacimiento asociados al virus del Zika. Por consiguiente, el análisis de los resultados de la RT-PCR en tejidos según la presencia de defectos de nacimiento estuvo limitado a estos embarazos. Infants and pregnancy losses with possible Zika virus–associated birth defects included pregnancies completed by December 25, 2016 that were reported to the USZPR and met the CDC surveillance case definition for possible Zika virus–associated birth defects as of May 18, 2017.** Completed pregnancies were classified as “tissue Zika virus RT-PCR–positive” if at least one placental (e.g., placental disc, umbilical cord, or fetal membranes) specimen or fetal/infant tissue specimen was positive by conventional Zika virus RT-PCR and confirmed by sequencing of PCR products (2). Una prueba RT-PCR con resultado positivo para el virus del Zika en tejidos placentarios es evidencia de infección materna por el virus del Zika This report includes cases reported previously (2,6–8).
Durante 2016, se enviaron a los CDC especímenes de tejidos de 627 embarazos finalizados con posible exposición materna al virus del Zika de los 50 estados y DC, los cuales fueron sometidos a las pruebas de RT-PCR en tejidos para el virus del Zika. Estos especímenes incluyeron tejidos placentarios de 546 nacimientos vivos y tejidos placentarios y/o fetales de 81 pérdidas de embarazos; también se realizaron pruebas IHC para el virus del Zika en especímenes de 91 nacimientos vivos y pérdidas de embarazos (15%), los criterios para los mismos se detallan más abajo. En general, 78 casos de un total de 627 (12%) presentaron uno o más especímenes de tejido placentario o fetal con resultados positivos para el virus del Zika por RT-PCR. De entre los 91 embarazos completados con especímenes de tejidos a los que se realizaron pruebas IHC, siete (8%) demostraron evidencia inmunohistoquímica de infección por el virus del Zika (seis de pérdidas de embarazo en el primer trimestre y una pérdida de embarazo en el segundo trimestre). Las siete pérdidas fetales con pruebas IHC positivas también tuvieron resultados positivos por RT-PCR en tejidos. Debido a que ninguno de los especímenes placentarios de pérdidas fetales en el tercer trimestre (n = 4) o nacimientos vivos (n = 47) a las que se les realizaron pruebas IHC dio resultados positivos, a partir de marzo del 2016, dejaron de realizarse pruebas IHC a este tipo de especímenes.
De entre 546 nacimientos vivos, los tejidos placentarios de 60 (11%) tuvieron resultados positivos para el virus del Zika por RT-PCR, incluidos 38/363 (10%) de embarazos con infección materna reciente por flavivirus no específico y 9/86 (10%) con IgM del virus del Zika negativa en la madre en casos donde se produjo una posible exposición materna >12 semanas antes de la obtención del suero (luego de lo cual los anticuerpos IgM del virus del Zika de la madre podrían haber disminuido) (5) (Tabla 2). La RT-PCR del virus del Zika fue negativa en tejidos placentarios de 34/47 (72%) nacimientos vivos con infección materna reciente por el virus del Zika confirmada y de los tres nacimientos vivos en los cuales se confirmó infección congénita por el virus del Zika en los bebés según las pruebas realizadas a los mismos. De entre los nacimientos vivos sin evidencia de infección materna por el virus del Zika (n = 14) o sin pruebas en especímenes clínicos maternos (n = 34), ninguno tuvo resultados positivos por RT-PCR en tejidos. En general, la RT-PCR para el virus del Zika dio resultados positivos en tejidos placentarios de 47/482 (10%) nacimientos vivos sin diagnóstico confirmado por pruebas para detectar el virus del Zika en especímenes clínicos de la madre o el bebé, para confirmar un diagnóstico de infección materna reciente por el virus del Zika. (imagen).
Las muestras de tejidos placentarios o fetales de 18 (22%) de las 81 pérdidas fetales dieron resultados positivos para el virus del Zika por RT-PCR, incluidas 4/13 (31%) con infección materna reciente por flavivirus no específico, 2/18 (11%) con IgM del virus del Zika negativa en la madre en casos donde se produjo una posible exposición materna >12 semanas antes de la obtención del suero, y 1/16 (6%) sin pruebas en muestras clínicas de la madre (Tabla 2). De entre 14 pérdidas fetales sin evidencia de infección materna por el virus del Zika, ninguno de los tejidos placentarios o fetales dio un resultado positivo por RT-PCR. Diez de 28 (36%) pérdidas fetales en el primer trimestre y 5/17 (29%) pérdidas fetales en el tercer trimestre tuvieron resultados positivos por RT-PCR en tejidos, en comparación con solo 3/35 (9%) pérdidas en el segundo trimestre (Tabla 2). Si embargo, 13/28 (46%) pérdidas fetales del primer trimestre tenían evidencia confirmada de infección materna reciente por el virus del Zika en especímenes clínicos, en comparación con 5/35 (14%) del segundo trimestre y 1/17 (6%) pérdidas fetales en el tercer trimestre.
De entre los 627 embarazos completados e incluidos en este informe, 449 (72%) se incluyeron en el USZPR (Tabla 2). Se reportaron treinta nacimientos vivos con posibles defectos de nacimiento asociados al virus del Zika. Dieciséis de estos (53%) tuvieron resultados positivos para el virus del Zika por RT-PCR en tejidos placentarios; sin embargo, una RT-PCR positiva sobre tejido placentario no permite distinguir entre una infección materna y una congénita. Diez de estos 16 tenían infección materna reciente por flavivirus no específico y seis dieron IgM del virus del Zika negativa en la madre en casos donde se produjo una posible exposición materna >12 semanas antes de la obtención del suero. De entre nueve nacimientos vivos con IgM del Zika negativa en la madre, en casos donde se produjo una posible exposición materna >12 semanas antes de la obtención del suero y RT-PCR positiva en tejidos placentarios, seis presentaron posibles defectos de nacimiento asociados al virus del Zika.
Discusión
En nacimientos vivos, la RT-PCR en tejidos placentarios proporcionó confirmación de infección materna reciente por el virus del Zika para 47 (10%) mujeres que de otro modo no contaban con un diagnóstico definitivo. Dada la complejidad de las pruebas de detección del virus del Zika y de las interpretaciones de las mismas, el análisis de especímenes de tejido ofrece otra oportunidad para confirmar una infección materna por el virus del Zika. Un diagnóstico de infección por el virus del Zika definitivo proporciona valiosa información para llevar adelante la evaluación y el control de bebés con posible exposición congénita.
Las pruebas por RT-PCR en tejido placentario fueron positivas en una proporción relativamente baja de nacimientos vivos con infección materna reciente por flavivirus no específico (10%) o IgM del virus del Zika negativa en la madre en suero obtenido >;12 semanas después de la posible exposición (10%). Las pruebas a la placenta podrían proporcionar información de diagnóstico adicional y pueden seguir teniéndose en cuenta en estos escenarios (https://www.cdc.gov/zika/pdfs/placental-testing-guidance.pdf), según la disponibilidad de los recursos de salud pública. Los resultados de las pruebas de detección del virus del Zika en tejidos placentarios deberían seguir siendo reexaminados a medida que se recopilen datos adicionales.
Los tejidos placentarios tienen componentes tanto de la madre como del feto, y la RT-PCR para el virus del Zika no puede distinguir entre ARN viral correspondiente a áreas de la madre y del feto (9). Si bien las pruebas a la placenta no pueden confirmar o excluir una infección congénita por el virus del Zika, puede ser más probable que los bebés reciban la evaluación clínica apropiada cuando la madre tiene confirmación de infección reciente por el virus del Zika. Los resultados negativos de RT-PCR en tejidos placentarios no descartan una infección por el virus del Zika materna o congénita; la evaluación de la mujer embarazada y el bebé para detectar el virus del Zika de conformidad con las directrices de los CDC es esencial para procurar el manejo clínico y el seguimiento adecuados de los bebés (3,4). Las pruebas de detección del virus del Zika y estudios por neuroimágenes realizados al bebé no deben demorarse mientras se esperan los resultados de las pruebas a la placenta.
De entre los nacimientos vivos con posibles defectos de nacimiento asociados al virus del Zika reportados al USZPR e incluidos en este análisis, 53% tuvieron resultados positivos para el virus del Zika por RT-PCR en tejidos placentarios. Todavía se desconocen las repercusiones de un resultado positivo para virus del Zika por RT-PCR en tejidos placentarios en cuanto a los resultados clínicos de los bebés. Sin embargo, otros estudios podrían explorar la relación entre la presencia de ARN del virus del Zika en especímenes de placenta, infección fetal y el desarrollo de posibles defectos de nacimiento asociados al virus del Zika.
En este informe, la IHC del virus del Zika solo fue positiva en tejidos fetales y placentarios de pérdidas fetales del primer y segundo trimestres. Resultados de IHC positiva para el virus del Zika en tejidos cerebrales de bebés muertos han sido reportados en otros estudios. (9,10). Although all IHC-positive cases were also RT-PCR–positive, IHC can provide valuable insight into viral localization and pathogenesis in pregnancy losses and infant deaths.
Los hallazgos de este informe están sujetos al menos a cinco limitaciones. Primero, una RT-PCR negativa para el virus del Zika en tejidos placentarios no excluye una infección materna por el virus del Zika. Factors that could lead to false-negative results include levels of viral RNA below the limit of assay detection, variability in tissue sampling, and degradation of viral RNA because of insufficient tissue fixation or prolonged formalin-fixation.†† Second, pregnancy outcomes in this analysis might not be representative of all pregnancies with possible Zika virus exposure, maternal Zika virus infection, or Zika virus–associated birth defects in the United States. Hay mayor probabilidad de que se envíen especímenes de tejido de embarazos que terminan en una pérdida o de fetos o bebés con defectos de nacimiento, particularmente en los casos de embarazos con IgM del virus del Zika negativa en la madre >;12 semanas después de la posible exposición. Third, possible testing bias limits the ability to compare placental test results by results of infant clinical laboratory testing, because infants with possible Zika virus–associated birth defects might be more likely to have Zika virus testing performed. Cuarto, el enfoque de las pruebas a tejidos placentarios y fetales ha cambiado con el tiempo, lo que puede haber resultado en variaciones en el sesgo de las pruebas a lo largo del período reportado. Los cambios incluyeron: la realización rutinaria de pruebas en especímenes de tejido para embarazos completados en los que la IgM materna del virus del Zika fue negativa >;12 después de la posible exposición (a partir de agosto de 2016) (3,4), y la concentración de las pruebas realizadas a especímenes de la placenta de nacimientos vivos en aquellos que no tenían un diagnóstico confirmado de infección materna reciente por el virus del Zika. (https://www.cdc.gov/zika/pdfs/placental-testing-guidance.pdf). Por último, la información clínica, epidemiológica y de laboratorio refleja los datos reportados al USZPR y la IDPB de los CDC hasta la fecha de este informe, y podría estar incompleta.
Estas conclusiones describen las contribuciones al diagnóstico de infección materna realizadas por las pruebas a tejidos placentarios y fetales para detectar la infección por el virus del Zika. Si bien la proporción de nacimientos vivos con tejidos placentarios positivos para el virus del Zika por RT-PCR fue baja, el análisis de tejidos puede ser valioso cuando las pruebas serológicas maternas no pueden diferenciar entre el virus del Zika y otros flavivirus relacionados o han sido realizadas >;12 semanas después de la posible exposición de la madre, y las pruebas para detección del virus del Zika en el bebé no son definitivas, son negativas o no se han realizado. El análisis de tejidos proporciona otra posibilidad de confirmar una infección materna por el virus del Zika, lo que puede ser importante tanto para las familias como para los proveedores de atención médica. Sin embargo, como una prueba de RT-PCR positiva para el virus del Zika en tejidos placentarios no puede distinguir entre una infección materna y una congénita, es importante seguir las directrices actuales de los CDC para pruebas de diagnóstico clínico y manejo de mujeres embarazadas con posible exposición al virus del Zika y bebés con posible infección congénita por el virus del Zika (3,4).
Reconocimientos
Equipo de respuesta al Zika de Alabama, Departamento de Salud Pública de Alabama; División de Salud Pública de Alaska; Departamento de Salud de Samoa Americana; División de Salud Pública de Delaware; División de Epidemiología, Vigilancia e Investigación de Enfermedades, Departamento de Salud del Distrito de Columbia; Departamento de Salud Pública de Iowa; Departamento de Salud y Medioambiente de Kansas; Grupo de trabajo sobre Zika en el embarazo del Departamento de Salud Pública de Kentucky, Departamento de Salud Pública de Kentucky; Grupo de trabajo del Registro de Casos de Zika en el Embarazo del Departamento de Salud y Servicios Humanos de Michigan; Oficina de Salud Pública, Informática y Epidemiología, División de Salud Pública y Conductual de Nevada; Programa de Enfermedades Zoonóticas del Departamento de Salud de Ohio; Servicio de Enfermedades Agudas del Departamento de Salud del Estado de Oklahoma; Programa de enfermedades graves y contagiosas de la División de Salud Pública de Oregón; Ministerio de Salud, República de las Islas Marshall; Departamento de Salud de las Islas Vírgenes de los Estados Unidos; Oficina de Epidemiología y División de Vigilancia e Investigación del Departamento de Salud de Virginia; los 35 distritos de salud local del Departamento de Salud de Virginia y sus respectivos epidemiólogos y personal de enfermería de los servicios de salud pública; División de Servicios Consolidados de Laboratorio de Virginia; Oficina de Salud Pública de Virginia Occidental, Oficina de Salud Materno-infantil y Familiar, Oficina de Epidemiología y Servicios de Prevención; División de Salud Pública de Wisconsin.
Colaboración con el Registro de Casos de Zika en el Embarazo en los EE. UU.
Melissa Kretschmer, MA, Departamento de Salud Pública del Condado de Maricopa, Departamento de Servicios de Salud de Arizona; Kara Tarter, MPH, Departamento de Servicios de Salud de Arizona; Hayley Yaglom, MS, MPH, Departamento de Servicios de Salud de Arizona; Shoruq Alhajmohammad, Departamento de Salud Pública de California; Dildeep Chhabra, MBBS, Departamento de Salud Pública de California; Wendy Jilek, MPH, Departamento de Salud Pública de California; Meghana Madala, Departamento de Salud Pública de California; Sharon Messenger, PhD, Departamento de Salud Pública de California; Charsey Cole Porse, PhD, Departamento de Salud Pública de California; Maria Salas, MPH, Departamento de Salud Pública de California; Diana Singh, Departamento de Salud Pública de California; Sarah Skallet, MPH, Departamento de Salud Pública de California; Similoluwa Sowunmi, MPH, Departamento de Salud Pública de California; Natalie S. Marzec, MD, Departamento de Salud Pública y medio ambiente de Colorado; Karin Davis, Departamento de Salud Pública de Connecticut; Brenda Esponda-Morrison, Departamento de Salud Pública de Connecticut; M. Zachariah Fraser, Departamento de Salud Pública de Connecticut; Colleen Ann O'Connor, MPH, Departamento de Salud Pública de Connecticut; Wendy M. Chung, MD, Departamento de Salud y Servicios Humanos del Condado de Dallas; Folasuyi Richardson, MPH, Departamento de Salud y Servicios Humanos del Condado de Dallas; Meredith E. Stocks, MPH, Departamento de Salud y Servicios Humanos del Condado de Dallas; Amanda Marie Bundek, División de Salud Pública de Delaware; Jennifer L. Zambri, MBA, División de Salud Pública de Delaware; Ashley Allen, Oficina de Laboratorios de Salud Pública del Departamento de Salud de Florida-Miami; Marie Ketty Etienne, MPH, Departamento de Salud de Florida en el Condado de Miami-Dade; Jennifer Jackson, MPH, Departamento de Salud de Florida en el Condado de Orange; Vanessa Landis, MPH, Departamento de Salud de Florida; Teresa Logue, MPH, Departamento de Salud de Florida en el Condado de Miami-Dade; Nicole Muse, MPH, Departamento de Salud de Florida en el Condado de Miami-Dade; Juliana Prieto, MPH, Departamento de Salud de Florida; Mercedes Rojas, Departamento de Salud de Florida en el Condado de Miami-Dade; Amanda Feldpausch, MPH, Departamento de Salud Pública de Georgia; Teri Graham, MPH, Departamento de Salud Pública de Georgia; Sylvia Mann, MS, Departamento de Salud de Hawái; Sarah Y. Park, MD, Departamento de Salud de Hawái; Debbie Freeman, Departamento de Salud Pública de Illinois; Emily J. Potts, MPH, Departamento de Salud del Estado de Indiana; Taryn Stevens, MPH, Departamento de Salud del Estado de Indiana; Sean Simonson, MPH, Departamento de Salud Louisiana; Julius L. Tonzel, MPH, Departamento de Salud Louisiana; Shari Davis, MPH, Departamento de Salud y Servicios Humanos de Maine; Sara Robinson, MPH, Departamento de Salud y Servicios Humanos de Maine; Judie K. Hyun, MHS, Departamento de Salud e Higiene Mental de Maryland; Erin Maureen Jenkins, MPH, Departamento de Salud e Higiene Mental de Maryland; Catherine Brown, DVM, Departamento de Salud Pública de Massachusetts; Susan Soliva, MPH, Departamento de Salud Pública de Massachusetts; Elizabeth Schiffman, MPH, MA, Departamento de Salud de Minnesota; Paul Byers, MD, Departamento de Salud del Estado de Mississippi; Sheryl Hand, Departamento de Salud del Estado de Mississippi; Christine L. Mulgrew, PhD, Departamento de Salud y Servicios Humanos de Montana; Jeff Hamik, MS, División de Salud Pública, Departamento de Salud y Servicios Humanos de Nebraska; Samir Koirala, MSc, División de Salud Pública, Departamento de Salud y Servicios Humanos de Nebraska; Elizabeth Ludwig, MD, División de Salud Pública, Departamento de Salud y Servicios Humanos de Nebraska; Carolyn R. Fredette, MPH, Departamento de Salud y Servicios Humanos de Nuevo Hampshire; Abigail A. Mathewson, DVM, Departamento de Salud y Servicios Humanos de Nuevo Hampshire; Kristin Garafalo, MPH, Departamento de Salud de Nueva Jersey; Karen Worthington, MS, Departamento de Salud de Nueva Jersey; Abubakar Ropri, MPH, Departamento de Salud de Nuevo México; Danielle Bloch, MPH, Departamento de Salud e Higiene Mental de la Ciudad de Nueva York; Sandhya Clark, MPH, Departamento de Salud e Higiene Mental de la Ciudad de Nueva York; Hannah Cooper, MBChB, Departamento de Salud e Higiene Mental de la Ciudad de Nueva York; Annie D. Fine, MD, Departamento de Salud e Higiene Mental de la Ciudad de Nueva York; Gili Hrusa, MPH, Departamento de Salud e Higiene Mental de la Ciudad de Nueva York; Martha Iwamoto, MD, Departamento de Salud e Higiene Mental de la Ciudad de Nueva York; Hannah Kubinson, MPH, Departamento de Salud e Higiene Mental de la Ciudad de Nueva York; Christopher T. Lee, Departamento de Salud e Higiene Mental de la Ciudad de Nueva York; Sally Slavinski, DVM, Departamento de Salud e Higiene Mental de la Ciudad de Nueva York; Eliza Wilson, Departamento de Salud e Higiene Mental de la Ciudad de Nueva York; Ann Winters, MD, Departamento de Salud e Higiene Mental de la Ciudad de Nueva York; David Yi Yang, Departamento de Salud e Higiene Mental de la Ciudad de Nueva York; Julius N. Ade, MD, Departamento de Salud del Estado de Nueva York; Zahra Alaali, MPH, Departamento de Salud del Estado de Nueva York; Kimberly Alvarez, MPH, Departamento de Salud del Estado de Nueva York; P. Bryon Backenson, MS, Departamento de Salud del Estado de Nueva York; Debra Blog, MD, Departamento de Salud del Estado de Nueva York; Amy Dean, PhD, Centro Wadsworth, Departamento de Salud del Estado de Nueva York; Elizabeth Dufort, MD, Departamento de Salud del Estado de Nueva York; Andrea Marias Furuya, PhD, Centro Wadsworth, Departamento de Salud del Estado de Nueva York; Meghan Fuschino, MS, Centro Wadsworth, Departamento de Salud del Estado de Nueva York; Rene Hull, Centro Wadsworth, Departamento de Salud del Estado de Nueva York; Matthew Kleabonas, Centro Wadsworth, Departamento de Salud del Estado de Nueva York; Karen Kulas, Centro Wadsworth, Departamento de Salud del Estado de Nueva York; Philip Kurpiel, PhD, Departamento de Salud del Estado de Nueva York; Lou Ann Lance, MSN, Departamento de Salud del Estado de Nueva York; Emaly Leak, MS, Centro Wadsworth, Departamento de Salud del Estado de Nueva York; Ronald J. Limberger, PhD, Centro Wadsworth, Departamento de Salud del Estado de Nueva York; Stephanie Ostrowski, PhD, Departamento de Salud del Estado de Nueva York; MaryJo Polfleit, Departamento de Salud del Estado de Nueva York; Amy Robbins, MPH, Departamento de Salud del Estado de Nueva York, Oficina para el Control de Enfermedades Contagiosas; Jemma V. Rowlands, MPH, Departamento de Salud del Estado de Nueva York; Inderbir Sohi, MSPH, Departamento de Salud del Estado de Nueva York, CDC; Jamie N. Sommer, MS, Departamento de Salud del Estado de Nueva York, Oficina para el Control de Enfermedades Contagiosas; Jennifer White, MPH, Departamento de Salud del Estado de Nueva York; Dorothy Wiley, Departamento de Salud del Estado de Nueva York; Li Zeng, Centro Wadsworth, Departamento de Salud del Estado de Nueva York; Ronna L. Chan, PhD, Departamento de Salud y Servicios Humanos de Carolina del Norte, División de Salud Pública; Jennifer MacFarquhar, MPH, Departamento de Salud y Servicios Humanos de Carolina del Norte, División de Salud Pública; Laura Cronquist, Departamento de Salud de Dakota del Norte; Leah Lind, MPH, Departamento de Salud de Pensilvania; Kumar Nalluswami, MD, Departamento de Salud de Pensilvania; Dana Perella, MPH, Departamento de Salud Pública de Filadelfia; Diane S. Brady, MS, Departamento de Salud de Rhode Island; Michael Gosciminski, MPH, Departamento de Salud de Rhode Island; Patricia McAuley, MSN, Departamento de Salud de Rhode Island; Bridget E. Teevan, MPH, Departamento de Salud de Rhode Island; Daniel Drociuk, Departamento de Salud y Control Ambiental de Carolina del Sur; Vinita Leedom, MPH, Departamento de Salud y Control Ambiental de Carolina del Sur; Brian Witrick, MPH, Departamento de Salud y Control Ambiental de Carolina del Sur; Jan Bollock, Departamento de Salud de Dakota del Sur; Lon Kightlinger, PhD, Departamento de Salud de Dakota del Sur; Marie Bottomley Hartel, MPH, Departamento de Salud de Tennessee; Loraine Swanson Lucinski, MPH, Departamento de Salud de Tennessee; Morgan McDonald, MD, Departamento de Salud de Tennessee; Angela M. Miller, PhD, Departamento de Salud de Tennessee; Tori Armand Ponson, MPH, Departamento de Salud de Tennessee; Laura Price, Departamento de Salud de Tennessee; Kelly Broussard, MPH, Departamento Estatal de Servicios de Salud de Texas; Amy E. Nance, MPH, Red de Utah para Defectos de Nacimiento, Departamento de Salud de Utah; Dallin Peterson, MPH, Departamento de Salud de Utah; Brennan Martin, MPH, Departamento de Salud de Vermont; Shea Browne, MS, Departamento de Salud de Virginia; LaToya A. Griffin-Thomas, PhD, División de Servicios Consolidados de Laboratorio de Virginia; Jennifer O. Macdonald, MPH, Departamento de Salud de Virginia; Jillian Neary, MPH, Departamento de Salud del Estado de Washington; Hanna Oltean, MPH, Departamento de Salud del Estado de Washington; Alys Adamski, PhD, CDC; Madelyn Baez-Santiago, PhD, CDC; Brigid C. Bollweg, MPH, CDC; Janet D. Cragan, MD, CDC; Yokabed Ermias, MPH, CDC; Lindsey B. C. Estetter, MS, CDC; Shannon Fleck-Derderian, MPH, CDC, ORISE; Cynthia S. Goldsmith, MGS, CDC; Matthew R. Groenewold, PhD, CDC; Heather Hayes, CDC; Irogue Igbinosa, MD, CDC; Tiffany Gayle Jenkinson, CDC; Abbey M. Jones, MPH, CDC; Amanda Lewis, CDC; Cynthia A. Moore, MD, PhD, CDC; Kimberly B. Newsome, MPH, CDC; Vaunita Parihar, CDC; Mitesh M. Patel, CDC; Anna Paulino, CDC; Sonja A. Rasmussen, MD, CDC; Meghan Raycraft, MPH, CDC; Megan R Reynolds, MPH, CDC; Dominique C. Rollin, MD, CDC; Jeanine H. Sanders, CDC; Carrie Shapiro-Mendoza, PhD, CDC; Luciana Silva-Flannery, PhD, CDC; Pamela Spivey, CDC; Alphonse K. Tshiwala, MPA, CDC; Tonya R. Williams, PhD, CDC.
Equipo de Patología, Grupo de Trabajo de Epidemiología y Vigilancia en Respuesta al Virus del Zika
William A. Bower, MD, CDC; Elizabeth Davlantes, MD, CDC, Servicio de Inteligencia Epidemiológica (EIS); Terra R. Forward, DO, CDC; Rena Fukunaga, PhD, CDC, EIS; Jonas Hines, MD, CDC; Shaohua Sean Hu, MD, DrPH, CDC; Jessica Leung, MPH, CDC; Lillianne Lewis, MD, CDC; Stacey Martin, MSc, CDC; Lucy McNamara, PhD, CDC; John D. Omura, MD, CDC; Candice L. Robinson, MD, CDC; Kristine Schmit, MD, CDC; Julie L. Self, PhD, CDC, EIS; Minesh Shah, MD, CDC; Anne Straily, DVM, CDC, EIS; Elizabeth A. Van Dyne, MD, CDC; Milan Vu, CDC; Charnetta Williams, MD, CDC, EIS.
Conflicto de intereses
Kirsten St. George informa subvenciones de Akonni Biosystems Inc., apoyo no financiero de ThermoFisher y un acuerdo de colaboración que genera regalías con Zeptometrix fuera del trabajo presentado. No se reportaron otros conflictos de intereses.
Autora para correspondencia: Sarah Reagan-Steiner, sor1@cdc.gov, 404-639-2811.
1División de Patología y Microorganismos Patógenos de Graves Consecuencias, Centro Nacional de Enfermedades Infecciosas Emergentes y Zoonóticas, CDC; 2División de Trastornos Congénitos y del Desarrollo, Centro Nacional de Defectos de Nacimiento y Discapacidades del Desarrollo, CDC; 3División de Salud Reproductiva, Centro Nacional para la Prevención de Enfermedades Crónicas y la Promoción de la Salud, CDC; 4División de Operaciones de Emergencia, Oficina de Preparación y Respuesta de Salud Pública, CDC; 5Departamento de Salud e Higiene Mental de la Ciudad de Nueva York; 6 Departamento de Salud Pública de Massachusetts; 7 Departamento de Salud de Florida, 8Departamento de Salud del Estado de Nueva York; 9Servicio de Inteligencia Epidemiológica, CDC; 10 División de prevención de VIH/SIDA, Centro Nacional para la Prevención del VIH/SIDA, la hepatitis viral, las ETS y la tuberculosis, CDC; 11 División de Riesgo Ambiental y Efectos en la Salud, Centro Nacional de Salud Ambiental, CDC; 12 Instituto Oak Ridge de Ciencia y Educación; 13 División de Enfermedades Infecciosas Transmitidas por Vectores, Centro Nacional de Enfermedades Infecciosas Emergentes y Zoonóticas, CDC; 14Oficina del Director, Centro Nacional de Enfermedades Infecciosas Emergentes y Zoonóticas, CDC.
* Posible exposición al virus del Zika incluye: 1) viajar a un área con riesgo de transmisión del virus del Zika y con aviso para viajeros de los CDC o vivir en una de ellas, o 2) mantener relaciones sexuales sin condón, durante el embarazo o el periodo periconcepcional, con una pareja que viajó a un área con riesgo de transmisión del virus del Zika y con aviso para viajeros de los CDC o vivió en una de ellas (https://www.cdc.gov/zika/geo/index.html).
† Las categorías de evidencia de laboratorio de bebés corresponden a los resultados de pruebas realizadas a especímenes clínicos de bebés o fetos (por ej., suero, sangre del cordón umbilical, orina, líquido cefalorraquídeo, líquido amniótico), sin embargo, si los valores de la PRNT del bebé no estaban disponibles, se usaron los valores de la PRNT del suero materno. Categories include the following: confirmed congenital Zika virus infection = positive by Zika virus RT-PCR, Zika virus IgM positive and Zika virus PRNT titer ≥10; probable congenital Zika virus infection = Zika virus IgM-positive, no PRNT titers reported, or Zika and dengue virus PRNT titers ≥10; negative infant Zika virus test results = neither Zika virus RT-PCR nor Zika virus IgM positive results; no infant specimen test results reported = testing could be not performed, not reported, or pending. Solo incluye resultados de pruebas clínicas de laboratorio para la detección del virus del Zika realizadas en los Estados Unidos y los territorios de los EE. UU. (https://wwwn.cdc.gov/nndss/conditions/zika/case-definition/2016/06/).
§ El trimestre en que se produjo la infección o posible exposición se determinó según la fecha de aparición de los síntomas, en el caso de mujeres embarazadas sintomáticas, o según el trimestre, o trimestres, en que se produjo la supuesta exposición por vía sexual o al vector, en el caso de las mujeres embarazadas asintomáticas. La exposición periconcepcional solo se define como infección o posible exposición durante las 8 semanas anteriores a la concepción (6 semanas antes y 2 semanas después del primer día de la última menstruación).
¶ Criterios de inclusión en el Registro de Casos de Zika en el Embarazo en los EE. UU. = mujeres embarazadas con evidencia de laboratorio de infección por el virus del Zika (resultados positivos o equívocos en la prueba, independientemente de si presentaron síntomas) y bebés nacidos de estas mujeres con exposición periconcepcional, prenatal o perinatal, y bebés con evidencia de laboratorio de infección congénita por el virus del Zika (resultados positivos o equívocos en la prueba, independientemente de si presentan síntomas) y sus madres (https://www.cdc.gov/zika/reporting/registry.html).
** Los defectos de nacimiento incluyen aquellos comprendidos en la definición de caso de vigilancia del USZPR para defectos de nacimiento posiblemente asociados a una infección por el virus del Zika durante el embarazo del 18 de mayo del 2017. Estos defectos de nacimiento incluyen anomalías cerebrales y/o microcefalia; calcificaciones intracraneales; ventrículomegalia, defectos del tubo neural y otras malformaciones cerebrales tempranas; anormalidades oculares; u otras consecuencias de la disfunción del sistema nervioso central, incluidas la artrogriposis (contracturas de las articulaciones), el pie equinovaro, la displasia congénita de cadera y la sordera congénita (https://www.cdc.gov/zika/geo/pregnancy-outcomes.html).
†† Las recomendaciones para la recolección y el envío de especímenes están disponibles en https://www.cdc.gov/zika/laboratories/test-specimens-tissues.html.
Referencias
- Rasmussen SA, Jamieson DJ, Honein MA, Petersen LR. Zika virus and birth defects-reviewing the evidence for causality. N Engl J Med 2016;374:1981-7. CrossRef PubMed
- Bhatnagar J, Rabeneck DB, Martines RB, et al. Zika virus RNA replication and persistence in brain and placental tissue. Emerg Infect Dis 2017;23:405-14. CrossRef PubMed
- Russell K, Oliver SE, Lewis L, et al. Update: interim guidance for the evaluation and management of infants with possible congenital Zika virus infection-United States, August 2016. MMWR Morb Mortal Wkly Rep 2016;65:870-8. CrossRef PubMed
- Oduyebo T, Igbinosa I, Petersen EE, et al. Update: interim guidance for health care providers caring for pregnant women with possible Zika virus exposure-United States, July 2016. MMWR Morb Mortal Wkly Rep 2016;65:739-44. CrossRef PubMed
- Rabe IB, Staples JE, Villanueva J, et al. ; MTS. Interim guidance for interpretation of Zika virus antibody test results. MMWR Morb Mortal Wkly Rep 2016;65:543-6. CrossRef PubMed
- Honein MA, Dawson AL, Petersen EE, et al. ; US Zika Pregnancy Registry Collaboration. Birth defects among fetuses and infants of US women with evidence of possible Zika virus infection during pregnancy. JAMA 2017;317:59-68. CrossRef PubMed
- Meaney-Delman D, Hills SL, Williams C, et al. Zika virus infection among U.S. pregnant travelers-August 2015-February 2016. MMWR Morb Mortal Wkly Rep 2016;65:211-4. CrossRef PubMed
- Reynolds MR, Jones AM, Petersen EE, et al. ; Colaboración con el Registro de Casos de Zika en el Embarazo en los EE. UU. Vital signs: update on Zika virus-associated birth defects and evaluation of all U.S. infants with congenital Zika virus exposure-U.S. Zika Pregnancy Registry, 2016. MMWR Morb Mortal Wkly Rep 2017;66:366-73. CrossRef PubMed
- Ritter JM, Martines RB, Zaki SR. Zika virus: pathology from the pandemic. Arch Pathol Lab Med 2017;141:49-59. CrossRef PubMed
- Martines RB, Bhatnagar J, de Oliveira Ramos AM, et al. Pathology of congenital Zika syndrome in Brazil: a case series. Lancet 2016;388:898-904. CrossRef PubMed
 TABLA 1. Categorías de evidencia de laboratorio de infección materna por el virus del Zika obtenida de pruebas a especímenes clínicos que no son tejidos (por ej., suero, orina)
TABLA 1. Categorías de evidencia de laboratorio de infección materna por el virus del Zika obtenida de pruebas a especímenes clínicos que no son tejidos (por ej., suero, orina)
| Categoría | Definición |
|---|---|
| Infección reciente por el virus del Zika confirmada | Positive Zika virus RT-PCR, or Zika or dengue virus IgM positive or equivocal* with Zika virus PRNT titer ≥10 and dengue virus PRNT titer <10 |
| Infección por flavivirus no específico reciente | Zika virus RT-PCR negative or not performed, with Zika or dengue virus IgM positive, or equivocal with Zika virus and dengue virus PRNT titers ≥10 |
| Muestras maternas negativas por IgM del virus del Zika, con exposición total o posible ocurrida >;12 semanas antes de la obtención del suero | RT-PCR para el virus del Zika negativa o no realizada, con IgM negativa del virus del Zika, con exposición total o posible ocurrida >12 semanas antes de la fecha de obtención del suero |
| Pendiente/desconocida | Resultados de pruebas pendientes o desconocidos |
| Sin evidencia de infección por el virus del Zika | IgM positiva o equívoca del Zika o el dengue, con PRNT para el virus del Zika a títulos |
| Sin pruebas a muestras clínicas de la madre | No se realizaron pruebas a suero, orina u otras especímenes clínicos de la madre |
Abbreviations: IgM = immunoglobulin M; PRNT = plaque-reduction neutralization test; RT-PCR = reverse transcription–polymerase chain reaction.
* La terminología utilizada en cuanto a las serologías varía según la prueba y los resultados que no son negativos pueden incluir: positivo, equívoco, presuntamente positivo o posiblemente positivo.
 TABLA 2. Resultados de pruebas RT-PCR para detectar el virus del Zika en muestras de tejidos placentarios y fetales fijados de embarazos completados cuyos especímenes* fueron enviados a la División de Patología de Enfermedades Infecciosas de los CDC, clasificados según resultado del embarazo - 50 estados de EE. UU. y Distrito de Columbia (n = 627), incluidos 449 reportados al Registro de Casos de Zika en el Embarazo en los EE. UU., entre enero y diciembre de 2016
TABLA 2. Resultados de pruebas RT-PCR para detectar el virus del Zika en muestras de tejidos placentarios y fetales fijados de embarazos completados cuyos especímenes* fueron enviados a la División de Patología de Enfermedades Infecciosas de los CDC, clasificados según resultado del embarazo - 50 estados de EE. UU. y Distrito de Columbia (n = 627), incluidos 449 reportados al Registro de Casos de Zika en el Embarazo en los EE. UU., entre enero y diciembre de 2016
| Todos los embarazos completados para los cuales se enviaron especímenes de tejido (n = 627) | ||||
|---|---|---|---|---|
| Características | Nacimientos vivos (n = 546) | Pérdidas fetales (n = 81) | ||
| N° de nacimientos vivos con especímenes de tejido analizados | N° de RT-PCR con resultado positivo en tejidos† (%) | N° de pérdidas fetales con especímenes de tejido analizados | N° de RT-PCR con resultado positivo en tejidos (%) | |
| Total | 546 | 60 (11) | 81 | 18 (22) |
| Resultados de pruebas clínicas del virus del Zika de la madre§ | ||||
| Infección reciente por el virus del Zika confirmada | 47 | 13 (28) | 19 | 11 (58) |
| Infección por flavivirus no específico reciente | 363 | 38 (10) | 13 | 4 (31) |
| Muestras maternas negativas por IgM del virus del Zika, con exposición total o posible ocurrida >12 semanas antes de la obtención del suero¶ | 86 | 9 (10) | 18 | 2 (11) |
| Sin pruebas a muestras clínicas de la madre** | 34 | — | 16 | 1 (6) |
| Pendiente/desconocida | 2 | — | 1 | — |
| Sin evidencia de posible infección por el virus del Zika | 14 | — | 14 | — |
| Resultados de pruebas clínicas del virus del Zika del beb醆 | ||||
| Infección congénita por el virus del Zika confirmada | 3 | — | NA | NA |
| Probable infección congénita por el virus del Zika | 46 | 9 (20) | NA | NA |
| Pruebas del virus del Zika negativas | 358 | 39 (11) | NA | NA |
| Sin resultados informados | 139 | 12 (9) | NA | NA |
| Trimestre de la infección o posible exposición§§ | ||||
| Solo el primer trimestre | 90 | 9 (10) | 41 | 12 (29) |
| Diferentes trimestres, incluso el primero | 291 | 32 (11) | 24 | 4 (17) |
| Solo segundo y/o tercer trimestre | 149 | 18 (12) | 4 | — |
| Solo periconcepcional | 11 | 1 (9) | 10 | 2 (20) |
| Desconocido/falta información | 5 | — | 2 | — |
| Estado de los síntomas de la madre | ||||
| Asintomático | 366 | 37 (10) | 56 | 7 (13) |
| Con síntomas | 176 | 23 (13) | 25 | 11 (44) |
| Se desconoce | 4 | — | — | — |
| Trimestre en que se produjo la pérdida fetal | ||||
| Pérdida fetal, primer trimestre | NA | NA | 28 | 10 (36) |
| Pérdida fetal, segundo trimestre | NA | NA | 35 | 3 (9) |
| Pérdida fetal, tercer trimestre | NA | NA | 17 | 5 (29) |
| Sin información | NA | NA | 1 | — |
| Completed pregnancies reported to the U.S. Zika Pregnancy Registry¶¶(n = 449) | ||||
| Características | Nacimientos vivos (n = 414) | Pérdidas fetales (n = 35) | ||
| Total | 414 | 60 (14) | 35 | 18 (51) |
| Posibles defectos de nacimiento asociados al virus del Zika*** | ||||
| Defectos de nacimiento reportados | 30 | 16 (53) | 4 | 2 (50) |
| Sin defectos de nacimiento reportados | 384 | 44 (11) | 31 | 16 (52) |
Abbreviations: IgM = immunoglobulin M; NA = not applicable; PRNT = plaque-reduction neutralization test; RT-PCR = reverse transcription–polymerase chain reaction.
* Incluye especímenes placentarios (de la placenta, membranas fetales o cordón umbilical) para los 546 nacimientos vivos y especímenes de la autopsia del bebé para seis de nueve muertes neonatales. Para las pérdidas fetales (abortos espontáneos, interrupciones voluntarias y mortinatos), incluye especímenes placentarios (de la placenta, membranas fetales o cordón umbilical) para 62 y especímenes fetales para 58 pérdidas fetales; en 38 casos se enviaron tanto especímenes fetales como placentarios.
†Tissue RT-PCR positive = at least one placental or fetal tissue specimen was positive by Zika virus RT-PCR.
§ Confirmed recent Zika virus infection = positive Zika virus RT-PCR, or Zika or dengue virus IgM positive or equivocal with Zika virus plaque-reduction neutralization test (PRNT) titer ≥10 and dengue virus PRNT titer <10; Recent unspecified flavivirus infection = negative or no Zika virus RT-PCR performed, with Zika or dengue virus IgM positive, or equivocal with Zika virus and dengue virus PRNT titers ≥10; Maternal samples negative by Zika virus IgM, all or part of possible exposure occurred >12 weeks before serum collection date = negative or no Zika virus RT-PCR performed; Zika virus IgM negative with all or part of possible exposure occurring >12 weeks before serum collection date; Pending/Unknown = Test results unknown or pending; No evidence of Zika virus infection = Zika or dengue virus IgM positive or equivocal with Zika virus PRNT titer <10 regardless of dengue virus PRNT titer, or Zika IgM negative where all possible exposure occurred within 2–12 weeks of serum collection date. Se aplica a los resultados de pruebas en especímenes clínicos maternos (por ejemplo, suero, orina). Solo incluye resultados de pruebas clínicas de laboratorio para la detección del virus del Zika realizadas en los Estados Unidos y los territorios de los EE. UU.
¶ Includes nine live births with negative maternal Zika virus IgM and Zika and dengue virus PRNT titers ≥10.
** Incluye dos nacimiento vivos con prueba materna de RT-PCR negativa en suero u orina con exposición total o posible ocurrida >12 semanas antes de la fecha de obtención del espécimen y sin prueba de IgM del virus del Zika.
†† Confirmed congenital Zika virus infection = positive Zika virus RT-PCR, Zika virus IgM positive and Zika virus PRNT titer ≥10; Probable congenital Zika virus infection = Zika virus IgM-positive, no PRNT titers reported, or Zika and dengue virus PRNT titers ≥10; Negative infant Zika virus test results = neither Zika virus RT-PCR nor Zika virus IgM positive results; No infant specimen test results reported = testing could be not performed, not reported, or pending. Se aplica a resultados de pruebas a especímenes clínicos de bebés o fetos (por ej., suero, sangre del cordón umbilical, orina, líquido cefalorraquídeo, líquido amniótico), sin embargo, si los valores de la PRNT del bebé no estaban disponibles, se usaron los valores de la PRNT del suero materno. Solo incluye resultados de pruebas clínicas de laboratorio para la detección del virus del Zika realizadas en los Estados Unidos y los territorios de los EE. UU.
§§ El trimestre en que se produjo la infección o posible exposición se determinó según la fecha de aparición de los síntomas, en el caso de mujeres embarazadas sintomáticas y, para mujeres asintomáticas, se basó en el trimestre, o trimestres, en que se produjo la supuesta exposición por vía sexual o al vector. La exposición periconcepcional solo se define como infección o posible exposición durante las 8 semanas anteriores a la concepción (6 semanas antes y 2 semanas después del primer día de la última menstruación).
¶¶ U.S. Zika Pregnancy Registry inclusion criteria = Pregnant women with laboratory evidence of Zika virus infection (positive or equivocal test results, regardless of whether they have had symptoms) and periconceptionally, prenatally, or perinatally exposed infants born to these women, and infants with laboratory evidence of congenital Zika virus infection (positive or equivocal test results, regardless of whether they had symptoms) and their mothers (https://www.cdc.gov/zika/reporting/registry.html).
*** Los defectos de nacimiento incluyen aquellos comprendidos en la definición de caso de vigilancia del Registro de Casos de Zika en el Embarazo en los EE. UU. para defectos de nacimiento posiblemente asociados a una infección por el virus del Zika durante el embarazo del 18 de mayo del 2017. Estos defectos de nacimiento incluyen anomalías cerebrales y/o microcefalia, calcificaciones intracraneales, ventrículomegalia, defectos del tubo neural y otras malformaciones cerebrales tempranas, anormalidades oculares; u otras consecuencias de la disfunción del sistema nervioso central, incluidas la artrogriposis (contracturas de las articulaciones), el pie equinovaro, la displasia congénita de cadera y la sordera congénita (https://www.cdc.gov/zika/geo/pregnancy-outcomes.html).
 FIGURA. Resultados de pruebas de RT-PCR para el virus del Zika en tejidos placentarios de nacimientos vivos sin evidencia clínica de laboratorio de infección reciente por el virus del Zika confirmada en las pruebas maternas ni infección por el virus del Zika congénita confirmada en las pruebas del bebé (n = 482),*,†,§ clasificados en categorías según los resultados de las pruebas clínicas del virus del Zika de la madre¶,** - 50 estados de los EE. UU. y el Distrito de Columbia, enero a diciembre del 2016
FIGURA. Resultados de pruebas de RT-PCR para el virus del Zika en tejidos placentarios de nacimientos vivos sin evidencia clínica de laboratorio de infección reciente por el virus del Zika confirmada en las pruebas maternas ni infección por el virus del Zika congénita confirmada en las pruebas del bebé (n = 482),*,†,§ clasificados en categorías según los resultados de las pruebas clínicas del virus del Zika de la madre¶,** - 50 estados de los EE. UU. y el Distrito de Columbia, enero a diciembre del 2016
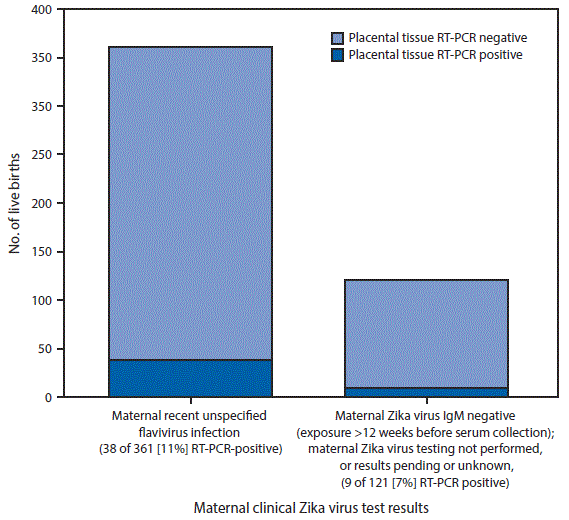
Abreviaturas: IgM = inmunoglobulina M; PRNT = prueba de neutralización por reducción de placas; RT-PCR = reacción en cadena de la polimerasa con transcriptasa inversa.
* Excludes live births with confirmed recent maternal Zika virus infection (positive Zika virus RT-PCR, or Zika or dengue virus IgM-positive or equivocal with Zika virus PRNT titer ≥10 and dengue virus PRNT titer <10) or no evidence of Zika virus infection (Zika or dengue virus IgM positive or equivocal with Zika virus PRNT titer <10 regardless of dengue PRNT titer, or Zika virus IgM negative where all possible exposure occurred within 2–12 weeks of serum collection date), or confirmed congenital Zika virus infection based on infant testing (positive Zika virus RT-PCR or Zika virus IgM positive and Zika virus PRNT titer ≥10 with dengue virus PRNT titer <10).
† Incluye 41 nacimientos vivos de bebés con evidencia de laboratorio de probable infección congénita por el virus del Zika; 9/41 (22%) con prueba de RT-PCR positiva en tejidos placentarios; y 441 nacimientos vivos de bebés con pruebas del virus del Zika negativas o sin información sobre pruebas para detectar el virus del Zika; 38/441 (9%) con prueba de RT-PCR positiva en tejido placentario. Los resultados positivos de la prueba de RT-PCR en tejidos placentarios proporcionan evidencia de infección materna reciente por el virus del Zika confirmada.
§ RT-PCR con resultado positivo en tejidos placentarios = al menos un espécimen de tejido placentario resultó positivo por RT-PCR para el virus del Zika.
¶ Recent unspecified flavivirus infection = negative or no Zika virus RT-PCR performed, with Zika or dengue virus IgM positive, or equivocal with Zika and dengue virus PRNT titers ≥10.
** Muestras maternas negativas por IgM del virus del Zika, con exposición total o posible ocurrida >12 semanas antes de la fecha de obtención del suero, con RT-PCR para el virus del Zika negativa o no realizada, pruebas para detectar el virus del Zika en la madre no realizadas o con resultados pendientes o desconocidos.
La figura de arriba es un gráfico de barra que muestra los resultados de pruebas de RT-PCR para el virus del Zika en tejidos placentarios de nacimientos vivos sin evidencia clínica de laboratorio de infección reciente por el virus del Zika confirmada en las pruebas maternas ni infección por el virus del Zika congénita confirmada en las pruebas del bebé, clasificados en categorías según los resultados de las pruebas clínicas del virus del Zika de la madre, en los 50 estados de los EE. UU. y el Distrito de Columbia, entre enero y diciembre del 2016.
Citación sugerida para este artículo: Reagan-Steiner S, Simeone R, Simon E, et al. Evaluation of Placental and Fetal Tissue Specimens for Zika Virus Infection - 50 States and District of Columbia, January-December, 2016. Informe Semanal de Morbilidad y Mortalidad (MMWR) 2017;66:636–643. DOI: http://dx.doi.org/10.16/mmwr.mm6624a3.
El uso de nombres de marcas y fuentes comerciales se utiliza solamente para efectos de identificación y no constituye aval alguno por parte del Departamento de Salud y Servicios Humanos de los EE. UU.
Las referencias de sitios en Internet que no son de los CDC se ofrecen como un servicio a los lectores del MMWR y no constituyen ni implican el aval de estas organizaciones o sus programas por parte de los CDC o del Departamento de Salud y Servicios Humanos de los EE. UU. Los CDC no son responsables por el contenido de las páginas de estos sitios. Las direcciones URL enumeradas en el MMWR estaban actualizadas hasta la fecha de la publicación.
Todas las versiones HTML de los artículos del MMWR son generadas de pruebas finales a través de procesos automatizados. Esta conversión podría resultar en la traducción de caracteres o errores de formato en la versión HTML. Los usuarios deben remitirse a la versión en PDF (https://www.cdc.gov/mmwr) o a la copia original en papel del MMWR para obtener versiones para imprimir del texto, las cifras y las tablas oficiales.
Las preguntas o mensajes con respecto a errores en el formato deben dirigirse a mmwrq@cdc.gov.
Ayuda con los formatos de archivos:
¿Cómo se visualizan los diferentes formatos de archivos (PDF, DOC, PPT, MPEG) en este sitio?- Esta página fue revisada el 22 de junio de 2017
- Esta página fue modificada el 22 de junio de 2017
- Fuente del contenido:


 CompartirCompartir
CompartirCompartir