Signos vitales: actualización sobre los defectos de nacimiento asociados al virus del Zika y la evaluación de todos los bebés de EE. UU. con exposición congénita al virus del Zika - Registro de Casos de Zika en el Embarazo en los EE. UU., 2016
Semanal /7 de abril de 2017 / 66(13);366-373
Datos del artículo
Las vistas equivalen a las vistas de páginas más las descargas de PDFVistas:
Citas:
Métricas alternativas:
Detalles de la métricaEl 4 de abril de 2017 se publicó este informe en línea como un adelanto del MMWR.
Megan R. Reynolds, MPH1; Abbey M. Jones, MPH1; Emily E. Petersen, MD2; Ellen H. Lee, MD3; Marion E. Rice, MPH1,4; Andrea Bingham, PhD5; Sascha R. Ellington, MSPH2; Nicole Evert, MS6; Sarah Reagan-Steiner, MD7; Titilope Oduyebo, MD2; Catherine M. Brown, DVM8; Stacey Martin, MSc9; Nina Ahmad, MD10; Julu Bhatnagar, PhD7; Jennifer Macdonald, MPH11; Carolyn Gould, MD9; Anne D. Fine, MD3; Kara D. Polen, MPH1; Heather Lake-Burger, MPH5; Christina L. Hillard, MA1; Noemi Hall, PhD6,12; Mahsa M. Yazdy, PhD8; Karnesha Slaughter, MPH1; Jamie N. Sommer, MS10; Alys Adamski, PhD1; Meghan Raycraft, MPH1; Shannon Fleck-Derderian, MPH4,13; Jyoti Gupta, MPH11; Kimberly Newsome, MPH1; Madelyn Baez-Santiago, PhD1; Sally Slavinski, DVM3; Jennifer L. White, MPH10; Cynthia A. Moore, MD, PhD1; Carrie K. Shapiro-Mendoza, PhD2; Lyle Petersen, MD9; Coleen Boyle, PhD14; Denise J. Jamieson, MD2; Dana Meaney-Delman, MD13; Margaret A. Honein, PhD1; colaboración del Registro de Casos de Zika en el Embarazo en los EE. UU. (ver las afiliaciones de los autores)
Ver la referencia bibliográfica sugeridaPuntos clave
• En el 2016, 44 estados reportaron un total de 1 297 embarazos con posible infección reciente por el virus del Zika al Registro de Casos de Zika en el Embarazo en los EE. UU.
• Aproximadamente uno de cada 10 embarazos con una infección por el virus del Zika confirmada en laboratorio resultó en un feto o bebé con defectos de nacimiento asociados con el virus del Zika.
• Las proporciones de fetos y bebés con defectos de nacimiento asociados al virus del Zika fueron mayores entre aquellos con infecciones por el virus del Zika durante el primer trimestre.
• Solo el 25% de los bebés de embarazos con posible infección reciente por el virus del Zika reportaron haber recibido ecografías cerebrales posteriores al nacimiento.
• La identificación y el chequeo de seguimiento de los bebés nacidos de madres con evidencia comprobada por laboratorio de una posible infección reciente por el virus del Zika durante el embarazo y los bebés con infección congénita por el virus del Zika pueden ayudar a que se pongan a disposición los servicios de intervención apropiados para los bebés infectados.
• Más información disponible en https://www.cdc.gov/vitalsigns/.
Resumen
Antecedentes: los CDC establecieron el Registro de Casos de Zika en el Embarazo en los EE. UU. (USZPR, por sus siglas en inglés) en colaboración con los departamentos de salud estatal, tribal, local y territorial a comienzos del 2016 para monitorear a mujeres embarazadas con prueba de laboratorio de posible infección reciente por el virus del Zika y a sus bebés.
Métodos: este informe incluye un análisis de los embarazos completados (que incluyen bebés nacidos vivos y pérdidas de embarazos, independientemente de la edad gestacional) en los 50 estados de EE. UU. y el Distrito de Columbia (DC) con evidencia de laboratorio de posible infección reciente por el virus del Zika reportada al USZPR desde el 15 de enero al 27 de diciembre del 2016. Los defectos de nacimiento potencialmente asociados a la infección por el virus del Zika durante el embarazo incluyen anomalías generales y/o microcefalia, anomalías oculares y otras consecuencias de la disfunción del sistema nervioso central, defectos del tubo neural y otras malformaciones cerebrales tempranas.
Resultados: durante el periodo de análisis, se reportaron al USZPR 1 297 mujeres embarazadas en 44 estados. Zika virus–associated birth defects were reported for 51 (5%) of the 972 fetuses/infants from completed pregnancies with laboratory evidence of possible recent Zika virus infection (95% confidence interval [CI] = 4%–7%); the proportion was higher when restricted to pregnancies with laboratory-confirmed Zika virus infection (24/250 completed pregnancies [10%, 95% CI = 7%–14%]). Se reportaron defectos de nacimiento en el 15% (95% CI = 8%–26%) de los fetos/bebés de embarazos completados con infección confirmada por el virus del Zika durante el primer trimestre. Entre 895 de los bebés nacidos vivos de embarazos con posible infección reciente por el virus del Zika, se reportó que se realizaron ecografías cerebrales posteriores al nacimiento en 221 (25%) y pruebas de virus del Zika de al menos un espécimen de bebé en 585 (65%).
Conclusiones y consecuencias para la práctica de salud pública: estos hallazgos enfatizan por qué las mujeres embarazadas deberían evitar la exposición al virus del Zika. Debido a que el espectro clínico total de la infección congénita por el virus del Zika aún se desconoce, todos aquellos bebés nacidos de mujeres con evidencia comprobada por laboratorio de una posible infección reciente por el virus del Zika durante el embarazo deberían recibir ecografías cerebrales posteriores al nacimiento y pruebas del virus del Zika, además de un examen físico integral y pruebas auditivas para recién nacidos. La identificación y el chequeo de seguimiento de los bebés nacidos de mujeres con evidencia comprobada por laboratorio de una posible infección reciente por el virus del Zika durante el embarazo y los bebés con posible infección congénita por el virus del Zika pueden ayudar a que se pongan a disposición los servicios de intervención apropiados.
Introducción
En respuesta al brote de virus del Zika en la Región de las Américas de la Organización Mundial de la Salud y la preocupación por los defectos de nacimiento vinculados con la infección por el virus del Zika durante el embarazo, los CDC emitieron un aviso para viajeros el 15 de enero del 2016 donde aconsejaban a las mujeres embarazadas que tuviesen en cuenta posponer los viajes a zonas con transmisión activa del virus del Zika. Como parte de la fase inicial de la respuesta a emergencias, los CDC colaboraron con los departamentos de salud estatal, tribal, local y territorial para establecer el Registro de Casos de Zika en el Embarazo en los EE. UU. (USZPR) como un sistema nacional mejorado de vigilancia para monitorear embarazos y resultados de fetos/bebés entre aquellas mujeres embarazadas con evidencia comprobada por laboratorio de una posible infección reciente por el virus del Zika (1). El USZPR incluye datos de mujeres embarazadas y de sus bebés al nacer y a las edades de 2, 6 y 12 meses.
Además, el USZPR incluye datos de 50 estados, DC y de todos los territorios de los EE. UU. excepto Puerto Rico; los embarazos en Puerto Rico son monitoreados por separado por el Sistema de vigilancia activa del virus del Zika durante el embarazo (2). Para ser incluido en el USZPR, la mujer embarazada, la placenta o el feto/bebé debe tener evidencia comprobada por laboratorio de una posible infección reciente por el virus del Zika. Las mujeres embarazadas en los Estados Unidos y en los territorios de EE. UU. (excepto por Puerto Rico) con evidencia comprobada por laboratorio de una posible infección reciente por el virus del Zika (independientemente de si presentan síntomas) y los bebés de estas mujeres con exposición periconcepcional*, prenatal o perinatal son elegibles para ser incluidos. El USZPR también incluye bebés con una posible infección congénita por el virus del Zika (independientemente de si tienen síntomas o presentan hallazgos al nacer) y a sus madres.
This report updates the previous report (3) from the USZPR and provides data on pregnancies completed in the 50 U.S. states and DC from December 1, 2015 through December 27, 2016, reported to CDC from January 15, 2016, through March 14, 2017.† Completed pregnancies include those of any length of gestation that end in a liveborn infant or a pregnancy loss. La prevalencia inicial de los defectos que concuerdan con aquellos que se han observado con la infección congénita por el virus del Zika fue de aproximadamente 2.9 por 1 000 bebés nacidos vivos en los años previos al Zika (4). Los hallazgos iniciales del USZPR representan un aumento aproximado de veinte veces mayor en defectos de nacimiento asociados al virus del Zika entre mujeres embarazadas con evidencia comprobada por laboratorio de una posible infección reciente por el virus del Zika, con un aumento aproximado de treinta veces mayor en anomalías cerebrales y/o microcefalia. Los datos actualizados de este informe también se pueden comparar con este punto de referencia (3,4).
Métodos
The USZPR defines laboratory evidence of possible recent Zika virus infection as 1) recent Zika virus infection detected by a Zika virus RNA nucleic acid test (NAT, e.g., reverse transcription-polymerase chain reaction [RT-PCR]) on any maternal, placental, or fetal/infant specimen or 2) detection of recent Zika virus infection or recent unspecified flavivirus infection by serologic tests on a maternal or infant specimen (i.e., either positive or equivocal Zika virus immunoglobulin M [IgM] AND Zika virus plaque reduction neutralization test [PRNT] titer ≥10, regardless of dengue virus PRNT value; or negative Zika virus IgM, AND positive or equivocal dengue virus IgM, AND Zika virus PRNT titer ≥10, regardless of dengue virus PRNT titer). Se incluyen los bebés con IgM positivo o equívoco para el virus del Zika, siempre que la PRNT confirmatoria se haya realizado en un espécimen de la madre o del bebé. El criterio de inclusión del laboratorio del USZPR se especifica como "posible" infección reciente por el virus del Zika porque el USZPR incluye pares madre-bebé con evidencia serológica de una infección reciente por flavivirus no específico, al igual que aquellos con una infección por el virus del Zika confirmada en laboratorio.
Se llevaron a cabo análisis en el USZPR en los embarazos completados en general de 50 estados de los EE. UU. y DC y de un subconjunto de embarazos completados que demostraron reciente infección confirmada por el virus del Zika (5,6). These are pregnancies in which the presence of Zika virus RNA in a maternal, placental, or fetal/infant specimen was documented by a positive NAT, or in which Zika virus IgM was positive or equivocal and Zika virus PRNT titer was ≥10 and dengue virus PRNT was <10.
Entre las mujeres que presentaban síntomas, el tiempo de gestación de la infección por el virus del Zika se calculó a partir de la fecha de aparición de los síntomas. Entre las mujeres asintomáticas, el trimestre de exposición se calculó a partir de las fechas de viaje a las áreas de transmisión activa del virus del Zika o la fecha de exposición sexual. First trimester exposure was classified into two categories: 1) women with symptoms or exposure in the first trimester only§ (defined as first trimester or first trimester and periconceptional period); and 2) women with exposure during multiple trimesters including the first trimester. No se realizaron cálculos para la exposición en otros trimestres debido a que los números eran muy bajos. Las mujeres embarazadas que no tuvieron exposición durante el primer trimestre pudieron haberla tenido solo en el periodo periconcepcional, el segundo trimestre, el tercer trimestre, o en el segundo y el tercero; en muchas otras mujeres, se perdió la información del trimestre de exposición.
The Zika virus–associated birth defects (henceforth referred to as “birth defects”) were analyzed in two mutually exclusive categories: 1) brain abnormalities and/or microcephaly regardless of the presence of additional birth defects, and 2) neural tube defects and other early brain malformations, eye abnormalities, and other consequences of central nervous system dysfunction, among fetuses and infants without evident brain abnormalities or microcephaly (7). Los expertos clínicos revisaron la información reportada para asegurarse de que cada feto o bebé con defectos de nacimiento cumpliera con los criterios de la definición de caso del USZPR.
Se calculó la proporción de fetos o bebés con defectos de nacimiento en embarazos completados entre mujeres embarazadas asintomáticas y sintomáticas, además de mujeres con exposición durante el primer trimestre, utilizando el intervalo de puntuación de Wilson y 95% CI para una proporción binomial. Los resultados de embarazos múltiples se contabilizaron una vez. Se realizaron cálculos por separado de embarazos con cualquier tipo de evidencia de laboratorio de infección reciente por el virus del Zika y para el subconjunto de embarazos con infección reciente por el virus del Zika confirmada por laboratorio. Para todos los bebés nacidos vivos con y sin defectos de nacimiento, se calculó la proporción que recibió ecografías cerebrales posteriores al nacimiento (ecografía craneal, tomografía computarizada o resonancia magnética), como así también la proporción que se sometió a pruebas de laboratorio para el virus del Zika reportadas para un espécimen de bebé. Los CDC publicaron directrices provisionales actualizadas para la evaluación y el manejo de bebés con posible infección congénita por el virus del Zika en agosto del 2016 (8), donde se estableció que las pruebas y ecografías cerebrales posteriores al nacimiento deberían realizarse de rutina en todos los bebés nacidos de mujeres con evidencia de laboratorio de infección por el virus del Zika durante el embarazo; se calculó la proporción de bebés con ecografías cerebrales realizadas antes y después de la publicación de estas directrices.
Resultados
Desde el 15 de enero hasta el 27 de diciembre del 2016, se reportaron al USZPR un total de 1 297 embarazos con posible infección reciente por el virus del Zika de 44 estados ( figura 1), incluidos 972 embarazos completados con resultados reportados (895 bebés nacidos vivos y 77 pérdidas de embarazo). Entre los embarazos completados, 599 (62%) mujeres embarazadas eran asintomáticas, 348 (36%) eran sintomáticas y 25 (3%) no tenían información sobre los síntomas ( Tabla 1).
Se reportaron defectos de nacimiento en 51 (5%) de los 972 embarazos completados con evidencia comprobada por laboratorio de una posible infección reciente por el virus del Zika. La proporción fue mayor entre los embarazos completados con infección por el virus del Zika confirmada (24/250, 10%). Entre los embarazos completados con infección por el virus del Zika confirmada, 217 de 250 (87%) obtuvieron resultados positivos por RT-PCR, incluidos 24 embarazos con un feto o bebé con defectos de nacimiento.
Se reportaron defectos de nacimiento en proporciones similares de fetos/bebés cuyas madres reportaron y no reportaron síntomas de la enfermedad por el virus del Zika durante el embarazo. Se reportaron anormalidades cerebrales y/o microcefalia en 43 (84%) de 51 fetos/bebés con defectos de nacimiento. Entre los embarazos con infección confirmada por el virus del Zika, se reportaron anormalidades cerebrales y/o microcefalia en 18 (75%) de 24 fetos/bebés con defectos de nacimiento. Los 51 fetos o bebés con defectos de nacimiento fueron de embarazos con exposición al virus del Zika en los siguientes 16 países/territorios con trasmisión activa del virus del Zika: Barbados, Belice, Brasil, Cabo Verde, Colombia, República Dominicana, El Salvador, Guatemala, Guyana, Haití, Honduras, Jamaica, México, Puerto Rico, República de las Islas Marshall y Venezuela.
Se reportaron defectos de nacimiento en una proporción más alta en fetos o bebés cuyas madres fueron infectadas durante el primer trimestre de embarazo. Entre 157 embarazos donde las mujeres tuvieron aparición de los síntomas o exposición a la infección por el virus del Zika durante el primer trimestre, se reportaron defectos de nacimiento en 14 (9%) fetos/bebés (Tabla 1). Cuando los embarazos con aparición de síntomas o exposición durante el primer trimestre se limitaron a aquellos con infección por el virus del Zika confirmada en laboratorio, nueve (15%) de los 60 embarazos completados reportaron defectos de nacimiento.
Entre los 895 bebés nacidos vivos, se reportaron al USZPR los resultados de las ecografías cerebrales posteriores al nacimiento para 221 (25%). Se reportaron los resultados de las pruebas por el virus del Zika de cualquier espécimen para 585 (65%) bebés; 94 (11%) de todos los 895 bebés nacidos vivos obtuvieron resultados positivos en las pruebas por el virus del Zika. Entre los 45 bebés nacidos vivos con defectos de nacimiento, 25 (56%) reportaron haber obtenido resultados positivos en las pruebas por el virus del Zika y 29 (64%) reportaron haber recibido ecografías cerebrales posteriores al nacimiento al USZPR ( Tabla 2). Entre los 850 bebés nacidos vivos sin defectos de nacimiento, 69 (8%) reportaron haber obtenido resultados positivos en las pruebas por el virus del Zika y 192 (23%) reportaron haber recibido ecografías cerebrales posteriores al nacimiento al USZPR El porcentaje de bebés que reportaron haber recibido ecografías cerebrales posteriores al nacimiento fue del 20% entre 406 nacidos en agosto del 2016, y del 28% entre 489 nacidos durante septiembre y diciembre del 2016, después de que se publicaron las directrices actualizadas de los CDC (8) ( figura 2).
Conclusiones y comentarios
La cantidad de mujeres embarazadas con evidencia comprobada por laboratorio de una posible infección reciente por el virus del Zika y la cantidad de fetos/bebés con defectos de nacimiento asociados al virus del Zika sigue aumentando en los Estados Unidos. La proporción de fetos y bebés con defectos de nacimiento entre embarazos con infección confirmada por el virus del Zika durante cualquier etapa del embarazo fue más de 30 veces mayor que la prevalencia inicial en los años previos al Zika, y una proporción mayor de aquellos con infecciones durante el primer trimestre tuvieron defectos de nacimiento (4). Si bien la microcefalia fue el primer defecto de nacimiento reconocido, reportado y asociado a la infección congénita por el virus del Zika, las anormalidades cerebrales asociadas al virus del Zika pueden ocurrir sin la microcefalia, y se necesitan las ecografías cerebrales para detectar estas anormalidades (9). Las ecografías cerebrales también se utilizan en otras infecciones congénitas para identificar anormalidades cerebrales; por ejemplo, los hallazgos por este tipo de ecografías en bebés con infección congénita por citomegalovirus se correlacionan con los resultados de neurodesarrollo (10). Se recomiendan las ecografías cerebrales posteriores al nacimiento en todos los bebés nacidos de mujeres con evidencia de laboratorio de infección por el virus del Zika para identificar aquellos bebés con anormalidades cerebrales que justifiquen la realización de más evaluaciones para asegurar que se brinde la intervención apropiada (8). En base a los datos reportados al USZPR, la mayoría de estos bebés no recibieron las ecografías cerebrales recomendadas. Además de los bebés con defectos de nacimiento, el seguimiento completo y la evaluación del desarrollo de rutina de todos los bebés nacidos de mujeres con evidencia comprobada por laboratorio de una posible infección reciente por el virus del Zika son fundamentales para identificar resultados a futuro potencialmente asociados a una infección congénita por el virus del Zika y para asegurar que se realicen las derivaciones correspondientes para recibir el apoyo y la atención de seguimiento apropiados.
Los resultados de este informe están sujetos al menos a cuatro limitaciones. En primer lugar, la parcialidad de selección puede afectar qué embarazos se reportan al USZPR, porque es más probable que se les realicen pruebas a las mujeres embarazadas con síntomas de la enfermedad por el virus del Zika que a las mujeres asintomáticas. Es más probable que se realicen pruebas por una infección por el virus del Zika a mujeres embarazadas con exposición al virus del Zika y anormalidades fetales detectadas antes del nacimiento o a bebés con defectos de nacimiento. Además, es más probable que los embarazos que resultaron en pérdida hayan tenido una infección por el virus del Zika confirmada y se les hayan realizado pruebas a la placenta o a otros especímenes patológicos (11). No obstante, cabe la posibilidad de que no se hayan reportado los defectos de nacimiento en los casos de pérdida de embarazo, incluso en los nacimientos de bebés sin vida. En segundo lugar, mientras que los CDC han trabajado estrechamente con los departamentos de salud estatales y locales para obtener toda la información, es posible que haya demoras en el reporte de ecografías cerebrales posteriores al nacimiento o de los resultados de pruebas del virus del Zika en bebés. Además, algunos de los embarazos incluidos en el análisis se completaron antes de la publicación de las directrices para bebés más recientes de los CDC (8) y, por lo tanto, es probable que no se hayan implementado las recomendaciones actuales para las ecografías cerebrales o las pruebas. En tercer lugar, las metodologías actuales de pruebas están limitadas en el sentido de que solo pueden identificar infecciones recientes por el virus del Zika (5) y pueden no detectar aquellas mujeres que se realizan pruebas cuando el ARN y/o el IgM del virus del Zika ya no es detectable; estos embarazos no se incluirían en el USZPR a menos que el feto/bebé o la placenta arrojaran un resultado de prueba positivo para el virus del Zika. Además, las pruebas serológicas no pueden discriminar inmediatamente entre flavivirus debido a la reactividad cruzada (5); por lo tanto, quizás algunos embarazos en el USZPR hayan tenido una infección reciente con otro flavivirus que no sea el del virus del Zika, lo que podría llevar a infravalorar la proporción de fetos/bebés afectados. Por este motivo, en este informe, se incluyó un subconjunto de embarazos con infección reciente por el virus del Zika confirmada por laboratorio. Por último, son limitados los datos disponibles sobre otros factores de riesgo de la madre para los defectos de nacimiento, que incluyen causas genéticas o infecciosas de otra índole, que pueden ser factores causales de algunos de los defectos de nacimiento reportados en este informe.
Estos hallazgos resaltan los riegos graves de padecer defectos de nacimiento por la infección por el virus del Zika durante el embarazo y destacan por qué las mujeres embarazadas deberían evitar la exposición al virus del Zika y que todas las mujeres embarazadas deberían ser evaluadas por una posible exposición al virus del Zika en cada visita prenatal, además de realizarles pruebas a las mujeres embarazadas y a los bebés según las directrices actuales (https://www.cdc.gov/zika/pdfs/zikapreg_screeningtool.pdf) (8,12). Se recomienda realizar pruebas del virus del Zika en bebés a 1) todos los bebés nacidos de mujeres con evidencia de laboratorio de infección por el virus del Zika durante el embarazo y 2) bebés con hallazgos que sugieran síndrome congénito por el virus del Zika, que hayan nacido de mujeres con un vínculo epidemiológico que sugiera una posible transmisión, independientemente de los resultados de la prueba materna. A los bebés sin anormalidades, nacidos de mujeres con un vínculo epidemiológico que sugiera una posible exposición al virus del Zika durante el embarazo y para quienes no se realizaron pruebas a la madre o se realizaron más de 12 semanas después de la exposición, se les debería realizar un examen integral. Si existe un interés acerca del seguimiento del bebé o si no se realizó una prueba materna, se deberían realizar pruebas por el virus del Zika al bebé. La evaluación inicial de los bebés debería incluir un examen físico integral, incluso un examen neurológico, ecografías cerebrales posteriores al nacimiento y un examen estándar de audición del recién nacido. Se pueden tener en cuenta otras evaluaciones según los hallazgos clínicos y de laboratorio; no obstante, se recomienda la evaluación del desarrollo de rutina como parte de la atención pediátrica (8). De acuerdo con los informes iniciales del USZPR, la mayoría de los bebés nacidos de mujeres con evidencia comprobada por laboratorio de una posible infección reciente por el virus del Zika durante el embarazo podrían no estar recibiendo las evaluaciones recomendadas (p. ej., las ecografías cerebrales posteriores al nacimiento). Los CDC están trabajando junto con los funcionarios de salud pública, las asociaciones profesionales y los proveedores de atención médica para aumentar la concientización y adhesión a las directrices de los CDC para la evaluación y el manejo de bebés con posible infección congénita por el virus del Zika. La identificación y el chequeo de seguimiento de los bebés nacidos de madres con evidencia comprobada por laboratorio de una posible infección reciente por el virus del Zika durante el embarazo y los bebés con una posible infección congénita por el virus del Zika pueden ayudar a que se pongan a disposición los servicios de intervención apropiados para los bebés infectados.
Reconocimientos
Equipo de respuesta al Zika de Alabama, Departamento de Salud Pública de Alabama; División de Salud Pública de Alaska; División de Epidemiología, Vigilancia e Investigación de Enfermedades, Departamento de Salud del Distrito de Columbia; Equipo de respuesta al zika del Departamento de Salud Pública de Illinois; Departamento de Salud Pública de Iowa; Departamento de Salud y Medioambiente de Kansas; Grupo de trabajo sobre zika en el embarazo del Departamento de Salud Pública de Kentucky; Grupo de trabajo del Registro de Casos de Zika en el Embarazo de Michigan, Departamento de Salud y Servicios Humanos de Michigan; Departamento de Salud y Servicios para Adultos Mayores de Misuri; Oficina de Salud Pública, Informática y Epidemiología, División de Salud Pública y Conductual de Nevada; Programa de enfermedades graves y contagiosas de la División de Salud Pública de Oregón; Centro de Epidemiología, enfermedades graves e infecciosas, Departamento de Salud de Rhode Island; División de Epidemiología y Vigilancia de Defectos de Nacimiento, Departamento Estatal de Servicios de Salud de Texas; División de Salud Pública de Wisconsin.
Colaboración con el Registro de Casos de Zika en el Embarazo en los EE. UU.
Jennifer Adair, MSW, Departamento de Salud Pública del Condado de Maricopa, Arizona; Irene Ruberto, PhD, Departamento de Servicios de Salud de Arizona; Dirk T. Haselow, MD, PhD, Departamento de Salud de Arkansas; Lucille Im, MPH, Departamento de Salud de Arkansas; Wendy Jilek, MPH, Departamento de Salud Pública de California; Monica S. Lehmann, MPH, MSN, Departamento de Salud Pública de California, Centro de Salud para la Familia, Programa de monitoreo de defectos de nacimiento de California; Richard Olney, MD, Departamento de Salud Pública de California; Charsey Cole Porse, PhD, Departamento de Salud Pública de California; Karen C. Ramstrom, DO, Departamento de Salud Pública de California; Similoluwa Sowunmi, MPH, Departamento de Salud Pública de California; Natalie S. Marzec, MD, Departamento de Salud Pública y Medio Ambiente de Colorado; Karin Davis, Departamento de Salud Pública de Connecticut; Brenda Esponda-Morrison, Departamento de Salud Pública de Connecticut; M. Zachariah Fraser, Departamento de Salud Pública de Connecticut; Colleen Ann O'Connor, MPH, Departamento de Salud Pública de Connecticut; Wendy Chung, MD, Departamento de Salud y Servicios Humanos del Condado de Dallas; Folasuyi Richardson, MPH, Departamento de Salud y Servicios Humanos del Condado de Dallas; Taylor Sexton, MPH,Departamento de Salud y Servicios Humanos del Condado de Dallas; Meredith E. Stocks, MPH, Departamento de Salud y Servicios Humanos del Condado de Dallas; Senait Woldai, MPH, Departamento de Salud y Servicios Humanos del Condado de Dallas; Amanda M. Bundek, División de Salud Pública de Delaware; Jennifer Zambri, MBA, División de Salud Pública de Delaware, Oficina de epidemiología de las enfermedades infecciosas; Cynthia Goldberg, Departamento de Salud del Condado de Miami-Dade, Departamento de Salud de Florida; Leah Eisenstein, MPH, Departamento de Salud de Florida; Jennifer Jackson, MPH, Departamento de Salud del Condado de Orange, Departamento de Salud de Florida; Russell Kopit, MPH, Departamento de Salud del Condado de Palm Beach, Departamento de Salud de Florida; Teresa Logue, MPH, Departamento de Salud del Condado de Miami-Dade, Departamento de Salud de Florida; Raphael Mendoza, Departamento de Salud del Condado de Broward, Departamento de Salud de Florida; Amanda Feldpausch, MPH, Departamento de Salud Pública de Georgia; Teri Graham, MPH, Departamento de Salud Pública de Georgia; Sylvia Mann, MS, Departamento de Salud de Hawái; Sarah Y. Park, MD, Departamento de Salud de Hawái; Kris Kelly Carter, DVM, División de Salud Pública de Idaho, CDC, Servicio de Salud Pública de los Estados Unidos; Emily J. Potts, MPH, Departamento de Salud del Estado de Indiana; Taryn Stevens, MPH, Departamento de Salud del Estado de Indiana; Sean Simonson, MPH, Departamento de Salud de Luisiana; Julius L. Tonzel, MPH, Departamento de Salud de Luisiana; Shari Davis, MPH, Centros para el Control y la Prevención de Enfermedades de Maine; Sara Robinson, MPH, Departamento de Salud y Servicios Humanos de Maine; Judie K. Hyun, MHS, Departamento de Salud e Higiene Mental de Maryland; Erin M. Jenkins, MPH, Departamento de Salud e Higiene Mental de Maryland; Monika Piccardi, Departamento de Salud e Higiene Mental de Maryland; Lawrence D. Reid, PhD, Departamento de Salud e Higiene Mental de Maryland; Julie E. Dunn, PhD, Departamento de Salud Pública de Massachusetts; Cathleen A. Higgins, Departamento de Salud Pública de Massachusetts; Angela E. Lin, MD, Hospital General Infantil de Massachusetts; Gerlinde S. Munshi, MA, Departamento de Salud Pública de Massachusetts; Kayleigh Sandhu, MPH, Departamento de Salud Pública de Massachusetts; Sarah J. Scotland, MPH, Departamento de Salud Pública de Massachusetts; Susan Soliva, MPH, Departamento de Salud Pública de Massachusetts; Glenn Copeland, MBA, Departamento de Salud y Servicios Humanos de Michigan; Kimberly A. Signs, DVM, Departamento de Salud y Servicios Humanos de Michigan; Elizabeth Schiffman, MPH, MA, Departamento de Salud de Minnesota; Paul Byers, MD, Departamento de Salud del Estado de Misisipi; Sheryl Hand, Departamento de Salud del Estado de Misisipi; Christine L. Mulgrew, PhD, Estado de Montana; Jeff Hamik, MS, División de Salud Pública, Departamento de Salud y Servicios Humanos de Nebraska; Samir Koirala, MSc, División de Salud Pública, Departamento de Salud y Servicios Humanos de Nebraska; Lisa A. Ludwig, MD, División de Salud Pública, Departamento de Salud y Servicios Humanos de Nebraska; Carolyn Rose Fredette, MPH, Departamento de Salud y Servicios Humanos de Nuevo Hampshire; Kristin Garafalo, MPH, Departamento de Salud de Nueva Jersey; Karen Worthington, MS, Departamento de Salud de Nueva Jersey; Abubakar Ropri, MPH, Departamento de Salud del Estado de Nuevo México; Julius Nchangtachi Ade, MD, DrPH, Departamento de Salud del Estado de Nueva York; Zahra S. Alaali, MPH, Departamento de Salud del Estado de Nueva York; Debra Blog, MD, Departamento de Salud del Estado de Nueva York; Scott J. Brunt, Wadsworth Center, Departamento de Salud del Estado de Nueva York; Patrick Bryant, PhD, Wadsworth Center, Departamento de Salud del Estado de Nueva York; Amy E. Burns, MS, Departamento de Salud del Estado de Nueva York; Steven Bush, MS, Wadsworth Center, Departamento de Salud del Estado de Nueva York; Kyle Carson, Departamento de Salud del Estado de Nueva York; Amy B. Dean, PhD, Wadsworth Center, Departamento de Salud del Estado de Nueva York; Valerie Demarest, Wadsworth Center, Departamento de Salud del Estado de Nueva York; Elizabeth M. Dufort, MD, Departamento de Salud del Estado de Nueva York; Alan P. Dupuis II, Wadsworth Center, Departamento de Salud del Estado de Nueva York; Ann Sullivan-Frohm, Departamento de Salud del Estado de Nueva York; Andrea Marias Furuya, PhD, Wadsworth Center, Departamento de Salud del Estado de Nueva York; Meghan Fuschino, MS, Wadsworth Center, Departamento de Salud del Estado de Nueva York; Viola H. Glaze, Health Research Inc; Jacquelin Griffin, Departamento de Salud del Estado de Nueva York; Christina Hidalgo, MPH, Departamento de Salud del Estado de Nueva York; Karen E. Kulas, Wadsworth Center, Departamento de Salud del Estado de Nueva York; Daryl M. Lamson, Wadsworth Center, Departamento de Salud del Estado de Nueva York; Lou Ann Lance, MSN, Departamento de Salud del Estado de Nueva York; William T. Lee, PhD, Wadsworth Center, Departamento de Salud del Estado de Nueva York; Ronald Limberger, PhD, Wadsworth Center, Departamento de Salud del Estado de Nueva York; Patricia S. Many, MS, Departamento de Salud del Estado de Nueva York; Mary J. Marchewka, Wadsworth Center, Departamento de Salud del Estado de Nueva York; Brenda Elizabeth Naizby, Departamento de Salud del Estado de Nueva York; MaryJo Polfleit, Departamento de Salud del Estado de Nueva York; Michael Popowich, Wadsworth Center, Departamento de Salud del Estado de Nueva York; Tabassum Rahman, MS, Departamento de Salud del Estado de Nueva York; Timothy Rem, Departamento de Salud del Estado de Nueva York; Amy E. Robbins, MPH, Departamento de Salud del Estado de Nueva York; Jemma V. Rowlands, MPH, Departamento de Salud del Estado de Nueva York; Chantelle Seaver, MS, Departamento de Salud del Estado de Nueva York; Kimberley A. Seward, MPH, Departamento de Salud del Estado de Nueva York; Lou Smith, MD, Departamento de Salud del Estado de Nueva York; Inderbir Sohi, MSPH, Departamento de Salud del Estado de Nueva York; Kirsten St. George, PhD, Wadsworth Center, Departamento de Salud del Estado de Nueva York; Maria I. Souto, MPH, Departamento de Salud del Condado de Rockland; Rachel Elizabeth Wester, MPH, Departamento de Salud del Estado de Nueva York; Susan J. Wong, PhD, Wadsworth Center, Departamento de Salud del Estado de Nueva York; Li Zeng, Wadsworth Center, Departamento de Salud del Estado de Nueva York; Joel Ackelsberg, MD, Departamento de Salud e Higiene Mental del Estado de Nueva York; Byron Alex, MD, Departamento de Salud e Higiene Mental del Estado de Nueva York; Vennus Ballen, MD, Departamento de Salud e Higiene Mental del Estado de Nueva York; Jennifer Baumgartner, MSPH, Departamento de Salud e Higiene Mental del Estado de Nueva York; Danielle Bloch, MPH, Departamento de Salud e Higiene Mental del Estado de Nueva York; Sandhya Clark, MPH, Departamento de Salud e Higiene Mental del Estado de Nueva York; Erin Conners, PhD, Departamento de Salud e Higiene Mental del Estado de Nueva York; Hannah Cooper, MBChB, Departamento de Salud e Higiene Mental del Estado de Nueva York; Alexander Davidson, MPH, Departamento de Salud e Higiene Mental del Estado de Nueva York; Catherine Dentinger, MS, MPH, Departamento de Salud e Higiene Mental del Estado de Nueva York; Bisram Deocharan, PhD, Departamento de Salud e Higiene Mental del Estado de Nueva York; Andrea DeVito, MPH, Departamento de Salud e Higiene Mental del Estado de Nueva York; Jie Fu, PhD, Departamento de Salud e Higiene Mental del Estado de Nueva York; Gili Hrusa, MPH, Departamento de Salud e Higiene Mental del Estado de Nueva York; Maryam Iqbal, MS, Departamento de Salud e Higiene Mental del Estado de Nueva York; Martha Iwamoto, MD, Departamento de Salud e Higiene Mental del Estado de Nueva York; Lucretia Jones, DrPH, Departamento de Salud e Higiene Mental del Estado de Nueva York; Hannah Kubinson, MPH, Departamento de Salud e Higiene Mental del Estado de Nueva York; Maura Lash, MPH, Departamento de Salud e Higiene Mental del Estado de Nueva York; Marcelle Layton, MD, Departamento de Salud e Higiene Mental del Estado de Nueva York; Christopher T. Lee, MD, Departamento de Salud e Higiene Mental del Estado de Nueva York; Dakai Liu, PhD, Departamento de Salud e Higiene Mental del Estado de Nueva York; Emily McGibbon, MPH, Departamento de Salud e Higiene Mental del Estado de Nueva York; Morgan Moy, MPH, Departamento de Salud e Higiene Mental del Estado de Nueva York; Stephanie Ngai, MPH, Departamento de Salud e Higiene Mental del Estado de Nueva York; Hilary B. Parton, MPH, Departamento de Salud e Higiene Mental del Estado de Nueva York; Eric Peterson, MPH, Departamento de Salud e Higiene Mental del Estado de Nueva York; Jose Poy, MPH, Departamento de Salud e Higiene Mental del Estado de Nueva York; Jennifer Rakeman, PhD, Departamento de Salud e Higiene Mental del Estado de Nueva York; Alaina Stoute, MPH, Departamento de Salud e Higiene Mental del Estado de Nueva York; Corinne Thompson, PhD, Departamento de Salud e Higiene Mental del Estado de Nueva York; Don Weiss, MD, Departamento de Salud e Higiene Mental del Estado de Nueva York; Emily Westheimer, MSc, Departamento de Salud e Higiene Mental del Estado de Nueva York; Ann Winters, MD, Departamento de Salud e Higiene Mental del Estado de Nueva York; Mohammad Younis, MS, MPA, Departamento de Salud e Higiene Mental del Estado de Nueva York; Ronna L. Chan, PhD, Departamento de Salud y Servicios Humanos de Carolina del Norte, División de Salud Pública; Laura Jean Cronquist, Departamento de Salud de Dakota del Norte, División de Control de Enfermedades; Lisa Caton, MS, Departamento de Salud del Estado de Oklahoma; Leah Lind, MPH, Departamento de Salud de Pensilvania; Kumar Nalluswami, MD, Departamento de Salud de Pensilvania; Dana Perella, MPH, Departamento de Salud Pública de Filadelfia ; Diane S. Brady, MS, Departamento de Salud de Rhode Island; Michael Gosciminski, MPH, Departamento de Salud de Rhode Island; Patricia McAuley, MSN, Departamento de Salud de Rhode Island; Daniel Drociuk, MT, Departamento de Salud y Control Ambiental de Carolina del Sur, División de Epidemiología de enfermedades graves; Vinita Leedom, MPH, Departamento de Salud y Control Ambiental de Carolina del Sur, División de Salud Materno-Infantil; Brian Witrick, MPH, Departamento de Salud y Control Ambiental de Carolina del Sur, División de Epidemiología de enfermedades graves; Jan Bollock, Departamento de Salud de Dakota del Sur DIS; Marie Bottomley Hartel, MPH, Departamento de Salud de Tennessee; Loraine Swanson Lucinski, MPH, Departamento de Salud de Tennessee; Morgan McDonald, MD, Departamento de Salud de Tennessee; Angela M. Miller, PhD, Departamento de Salud de Tennessee; Tori Armand Ponson, MPH, Departamento de Salud de Tennessee; Laura Price, Departamento de Salud de Tennessee; Amy E. Nance, MPH, Red de defectos de nacimiento de Utah, Departamento de Salud de Utah; Dallin Peterson, Departamento de Salud de Utah; Sally Cook, Departamento de Salud de Vermont; Brennan Martin, MPH, Departamento de Salud de Vermont; Hanna Oltean, MPH, Departamento de Salud del Estado de Washington; Jillian Neary, MPH, Departamento de Salud del Estado de Washington; Melissa A. Baker, MA, Oficina de salud familiar y materno-infantil de Virginia Occidental; Kathy Cummons, MSW, Oficina de salud familiar y materno-infantil de Virginia Occidental; Katie Bryan, MPH, Departamento de Salud de Wyoming; Kathryn E. Arnold, MD, CDC; Annelise C. Arth, MPH, CDC; Brigid C. Bollweg, MPH, CDC; Janet D. Cragan, MD, CDC; April L. Dawson, MPH, CDC; Amy M. Denison, PhD, CDC; Eric J. Dziuban, MD, CDC; Lindsey Estetter, MS, CDC; Luciana Silva-Flannery, PhD, CDC; Rebecca J. Free, MD, CDC; Romeo R. Galang, MD, CDC; Joy Gary, DVM, PhD, CDC; Cynthia S. Goldsmith, MGS, CDC; Caitlin Green, MPH, CDC; Gillian L. Hale, MD, CDC; Heather M. Hayes, CDC; Irogue Igbinosa, MD, CDC; M. Kelly Keating, DVM, CDC; Sumaiya Khan, MPH, CDC, ORISE; Shin Y. Kim, MPH, CDC; Margaret Lampe, MPH, CDC; Amanda Lewis, CDC; Cara Mai, PhD, CDC; Roosecelis Brasil Martines, MD, PhD, CDC; Brooke Miers, MS, CDC; Jazmyn Moore, MPH, CDC; Atis Muehlenbachs, MD, PhD, CDC; John Nahabedian, MS, CDC; Amanda Panella, MPH, CDC; Vaunita Parihar, CDC; Mitesh M. Patel, CDC; D. Brett Rabeneck, MS, CDC; Sonja A. Rasmussen, MD, CDC; Jana M. Ritter, DVM, CDC; Dominique C. Rollin, MD, CDC; Jeanine H. Sanders, CDC; Wun-Ju Shieh, MD, PhD, CDC; Regina M. Simeone, MPH, CDC; Elizabeth L. Simon, MPH, CDC; John R. Sims, CDC; Pamela J. Spivey, CDC; Helen Talley-McRae, CDC; Alphonse K. Tshiwala, MPA, CDC; Kelley VanMaldeghem, MPH, CDC; Laura Viens, MD, CDC; Anne Wainscott-Sargent, Carter Consulting; Tonya Williams, PhD, CDC; Sherif Zaki, MD, PhD, CDC; todas estas personas reúnen los criterios para ser colaboradores.
Autor responsable de la correspondencia: Margaret A. Honein, eocbirthdef@cdc.gov, 404-639-3286.
1División de Trastornos Congénitos y del Desarrollo, Centro Nacional de Defectos Congénitos y Discapacidades del Desarrollo, CDC; 2División de Salud Reproductiva, Centro Nacional para la Prevención de Enfermedades Crónicas y la Promoción de la Salud, CDC; 3Departamento de Salud e Higiene Mental de la Ciudad de Nueva York; 4Instituto Oak Ridge de Ciencia y Educación; 5Departamento de Salud de Florida; 6Departamento Estatal de Servicios de Salud de Texas; 7División de Patología y Microorganismos Patógenos de Graves Consecuencias, Centro Nacional de Enfermedades Infecciosas Emergentes y Zoonóticas, CDC; 8Departamento de Salud Pública de Massachusetts; 9División de Enfermedades Transmitidas por Vectores, Centro Nacional de Enfermedades Infecciosas Emergentes y Zoonóticas, CDC; 10Departamento de Salud del Estado de Nueva York; 11Departamento de Salud de Virginia; 12Servicio de Inteligencia Epidemiológica, CDC; 13Oficina del Director, Centro Nacional de Enfermedades Infecciosas Emergentes y Zoonóticas, CDC; 14Oficina del Director, Centro Nacional de Defectos Congénitos y Discapacidades del Desarrollo, CDC.
* La exposición periconcepcional es la infección materna por el virus del Zika durante las 8 semanas anteriores a la concepción (6 semanas antes y 2 semanas después del primer día de la última menstruación).
† Datos sobre embarazos reportados a los CDC al 27 de diciembre del 2016; todos los datos han sido actualizados con más información reportada sobre estos embarazos hasta el 14 de marzo del 2017. Los embarazos completados se limitan a aquellos con una fecha de gestación completa hasta el 27 de diciembre del 2016.
§ El primer trimestre es la última menstruación +14 días a 13 semanas, 6 días (97 días).
Referencias
- Meaney-Delman D, Hills SL, Williams C, et al. Zika virus infection among U.S. pregnant travelers, August 2015-February 2016. MMWR Morb Mortal Wkly Rep 2016;65:211-4. CrossRef PubMed
- Simeone RM, Shapiro-Mendoza CK, Meaney-Delman D, et al. ; Zika and Pregnancy Working Group. Possible Zika virus infection among pregnant women-United States and Territories, May 2016. MMWR Morb Mortal Wkly Rep 2016;65:514-9. CrossRef PubMed
- Honein MA, Dawson AL, Petersen EE, et al. ; US Zika Pregnancy Registry Collaboration. Birth defects among fetuses and infants of US women with evidence of possible Zika virus infection during pregnancy. JAMA 2017;317:59-68. CrossRef PubMed
- Cragan JD, Mai CT, Petersen EE, et al. Baseline prevalence of birth defects associated with congenital Zika virus infection-Massachusetts, North Carolina, and Atlanta, Georgia, 2013-2014. MMWR Morb Mortal Wkly Rep 2017;66:219-22. CrossRef PubMed
- Rabe IB, Staples JE, Villanueva J, et al. ; MTS. Interim guidance for interpretation of Zika virus antibody test results. MMWR Morb Mortal Wkly Rep 2016;65:543-6. CrossRef PubMed
- Consejo de Epidemiólogos Estatales y Territoriales. Zika virus disease and Zika virus infection 2016 case definition. CSTE position statement 16-IC-01. Atlanta, GA: Council of State and Territorial Epidemiologists; 2016. https://wwwn.cdc.gov/nndss/conditions/zika/case-definition/2016/06/
- Moore CA, Staples JE, Dobyns WB, et al. Characterizing the pattern of anomalies in congenital Zika syndrome for pediatric clinicians. JAMA Pediatr 2017;171:288-95. CrossRef PubMed
- Russell K, Oliver SE, Lewis L, et al. ; Contributors. Update: interim guidance for the evaluation and management of infants with possible congenital Zika virus infection-United States, August 2016. MMWR Morb Mortal Wkly Rep 2016;65:870-8. CrossRef PubMed
- van der Linden V, Pessoa A, Dobyns W, et al. Description of 13 infants born during October 2015-January 2016 with congenital Zika virus infection without microcephaly at Birth-Brazil. MMWR Morb Mortal Wkly Rep 2016;65:1343-8. CrossRef PubMed
- Alarcon A, Martinez-Biarge M, Cabañas F, Quero J, García-Alix A. A prognostic neonatal neuroimaging scale for symptomatic congenital cytomegalovirus infection. Neonatology 2016;110:277-85. CrossRef PubMed
- Bhatnagar J, Rabeneck DB, Martines RB, et al. Zika virus RNA replication and persistence in brain and placental tissue. Emerg Infect Dis 2017;23:405-14. CrossRef PubMed
- Oduyebo T, Igbinosa I, Petersen EE, et al. Update: interim guidance for health care providers caring for pregnant women with possible Zika virus exposure-United States, July 2016. MMWR Morb Mortal Wkly Rep 2016;65:739-44. CrossRef PubMed
 FIGURA 1. Número acumulativo de casos de mujeres embarazadas con evidencia comprobada por laboratorio de una posible infección reciente por el virus del Zika reportado al Registro de Casos de Zika en el Embarazo en los EE. UU., por mes de informe - Estados Unidos, enero-diciembre del 2016 (n = 1,297)
FIGURA 1. Número acumulativo de casos de mujeres embarazadas con evidencia comprobada por laboratorio de una posible infección reciente por el virus del Zika reportado al Registro de Casos de Zika en el Embarazo en los EE. UU., por mes de informe - Estados Unidos, enero-diciembre del 2016 (n = 1,297)
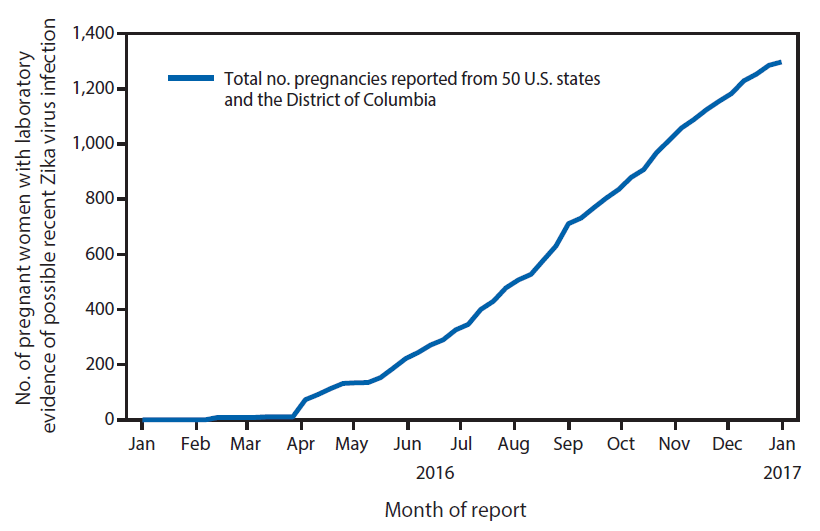
La figura de arriba es un gráfico de líneas que muestra la cantidad acumulativa de mujeres embarazadas con evidencia comprobada por laboratorio de una posible infección reciente por el virus del Zika reportada al Registro de Casos de Zika en el Embarazo en los EE. UU., por mes de informe en los Estados Unidos, durante enero-diciembre del 2016.
 TABLA 1. Resultados de embarazos* de 972 mujeres con embarazos completados† con evidencia comprobada por laboratorio de una posible infección reciente por el virus del Zika, por estado de los síntomas de la madre y el tiempo transcurrido desde la aparición de los síntomas - Registro de Casos de Zika en el Embarazo en los EE. UU., Estados Unidos, diciembre del 2015-diciembre del 2016
TABLA 1. Resultados de embarazos* de 972 mujeres con embarazos completados† con evidencia comprobada por laboratorio de una posible infección reciente por el virus del Zika, por estado de los síntomas de la madre y el tiempo transcurrido desde la aparición de los síntomas - Registro de Casos de Zika en el Embarazo en los EE. UU., Estados Unidos, diciembre del 2015-diciembre del 2016
| Características | Anormalidades cerebrales y/o microcefalia (cant.) | NTD y otras malformaciones cerebrales tempranas, anormalidades oculares o consecuencias de la disfunción del sistema nervioso central sin anormalidades cerebrales o microcefalia (cant.) | Total with ≥1 birth defect (No.) | Embarazos completados (cant.) | Proporción afectada con defectos de nacimiento asociados al virus del Zika, % (95% CI§) |
|---|---|---|---|---|---|
| Cualquier evidencia de laboratorio que indica posible infección por el virus del Zika¶ | |||||
| Total | 43 | 8 | 51 | 972 | 5 (4–7) |
| Estado de los síntomas de la madre | |||||
| Síntomas reportados de la infección por el virus del Zika | 18 | 3 | 21 | 348 | 6 (4–9) |
| Sin síntomas reportados de la infección por el virus del Zika | 24 | 4 | 28 | 599 | 5 (3–7) |
| Se desconoce | 1 | 1 | 2 | 25 | — |
| Tiempo de los síntomas o la exposición** | |||||
| Primer trimestre††,§§ | 13 | 1 | 14 | 157 | 9 (5–14) |
| Varios trimestres, incluso el primero | 22 | 6 | 28 | 396 | 7 (5–10) |
| Evidencia confirmada de la infección por el virus del Zika¶¶ | |||||
| Total | 18 | 6 | 24 | 250 | 10 (7–14) |
| Estado de los síntomas de la madre | |||||
| Síntomas reportados de la infección por el virus del Zika | 8 | 3 | 11 | 141 | 8 (4–13) |
| Sin síntomas reportados de la infección por el virus del Zika | 10 | 2 | 12 | 102 | 12 (7–19) |
| Se desconoce | 1 | 0 | 1 | 7 | — |
| Tiempo de los síntomas o la exposición** | |||||
| Primer trimestre††,§§ | 8 | 1 | 9 | 60 | 15 (8–26) |
| Varios trimestres, incluso el primero | 8 | 4 | 12 | 58 | 21 (12–33) |
Abbreviations: CI = confidence interval; CNS = central nervous system; IgM= immunoglobulin M; NAT=nucleic acid test; NTD = neural tube defect; PRNT = plaque reduction neutralization test; RT-PCR = reverse transcription–polymerase chain reaction.
* Los resultados de embarazos de gestación múltiple se contabilizan una vez.
† Incluye bebés nacidos vivos, abortos espontáneos, interrupciones voluntarias y nacimientos de bebés sin vida.
§ 95% CI para una proporción binomial utilizando el intervalo de puntuación de Wilson.
¶ Incluye evidencia de la madre, la placenta o el feto/bebé comprobada por laboratorio de una posible infección reciente por el virus del Zika en base a la presencia de ARN del virus del Zika mediante un resultado positivo de NAT (p. ej., RT-PCR) o una prueba similar, evidencia serológica de una infección reciente por el virus del Zika o evidencia serológica de una infección por flavivirus no específico reciente.
** No se realizaron cálculos para la exposición en otros trimestres debido a que los números eran muy bajos. Las mujeres embarazadas que no han tenido exposición durante el primer trimestre pueden haber estado expuestas solo durante el periodo periconcepcional (8 semanas antes de la concepción o 6 semanas antes y 2 semanas después del primer día de la última menstruación), el segundo trimestre, el tercer trimestre, en el segundo y el tercero; en muchas otras mujeres, se perdió la información del trimestre de exposición.
†† El primer trimestre es la última menstruación +14 días a 13 semanas, 6 días (97 días).
§§ El primer trimestre de exposición incluye a mujeres con exposición limitada al primer trimestre y a mujeres con exposición limitada al primer trimestre y al periodo periconcepcional.
¶¶ Includes maternal, placental, or fetal/infant laboratory evidence of confirmed Zika virus infection based on presence of Zika virus RNA by a positive NAT (e.g., RT-PCR) or similar test or serological results of IgM positive/equivocal with Zika PRNT ≥10 and dengue PRNT <10.
 TABLA 2. Ecografías cerebrales posteriores al nacimiento* y resultados de pruebas del virus del Zika en 895 bebés nacidos vivos en el Registro de Casos de Zika en el Embarazo en los EE. UU. - 50 estados de los EE. UU y el Distrito de Columbia, 2016
TABLA 2. Ecografías cerebrales posteriores al nacimiento* y resultados de pruebas del virus del Zika en 895 bebés nacidos vivos en el Registro de Casos de Zika en el Embarazo en los EE. UU. - 50 estados de los EE. UU y el Distrito de Columbia, 2016
| Pruebas | Cant. (%) de bebés nacidos vivos | ||
|---|---|---|---|
| Con defectos de nacimiento | Sin defectos de nacimiento | Total | |
| Total | 45 | 850 | 895 |
| Ecografías cerebrales | |||
| Cualquier ecografía cerebral reportada al USZPR | 29 (64) | 192 (23) | 221 (25) |
| Prueba de detección del virus del Zika en bebés | |||
| Resultado positivo de la prueba en un espécimen de bebé†,§ | 25 (56) | 69 (8) | 94 (11) |
| Negative infant test results among infants with ≥1 infant specimen reported as tested | 17 (38) | 474 (56) | 491 (55) |
| No se reportaron resultados de pruebas de especímenes de bebés al USZPR | 3 (7) | 307 (36) | 310 (35) |
Abbreviations: IgM= immunoglobulin M; NAT=nucleic acid test; RT-PCR = reverse transcription–polymerase chain reaction; USZPR = U.S. Zika Pregnancy Registry.
* Las ecografías cerebrales incluyen cualquier ecografía intracraneal, tomografía computarizada o pruebas de resonancia magnética reportadas al USZPR.
† Las pruebas con resultados positivos de los bebés incluyeron la presencia del ARN del virus del Zika mediante un NAT positivo (p. ej., RT-PCR) y/o los resultados serológicos del IgM positivo/equívoco.
§ Los especímenes de bebé incluyen suero, orina, sangre, líquido cefalorraquídeo, suero y sangre del cordón umbilical.
 FIGURA 2. Ecografías cerebrales posteriores al nacimiento de bebés reportados al Registro de Casos de Zika en el Embarazo en los EE. UU., por mes de nacimiento - Estados Unidos, diciembre del 2015 a diciembre del 2016
FIGURA 2. Ecografías cerebrales posteriores al nacimiento de bebés reportados al Registro de Casos de Zika en el Embarazo en los EE. UU., por mes de nacimiento - Estados Unidos, diciembre del 2015 a diciembre del 2016
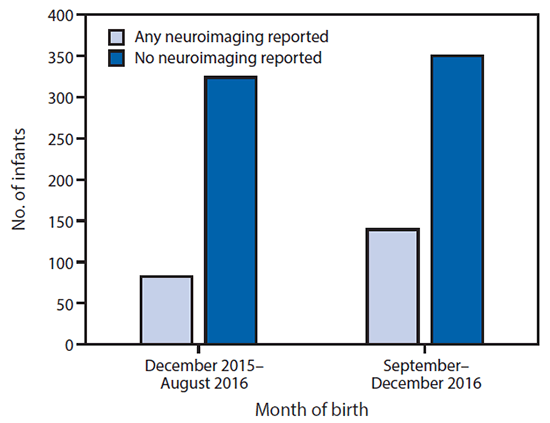
La figura de arriba es un gráfico de barras que muestra las ecografías cerebrales posteriores al nacimiento de bebés reportados al Registro de Casos de Zika en el Embarazo en los EE. UU., por mes de nacimiento, en los Estados Unidos, durante diciembre del 2015 a diciembre del 2016.
Citación sugerida para este artículo: Reynolds MR, Jones AM, Petersen EE, et al. Signos vitales: actualización sobre los defectos de nacimiento asociados al virus del Zika y la evaluación de todos los bebés de EE. UU. con exposición congénita al virus del Zika - Registro de Casos de Zika en el Embarazo en los EE. UU., 2016. Informe Semanal de Morbilidad y Mortalidad (MMWR) 2017;66:366-373. DOI: http://dx.doi.org/10.16/mmwr.mm6613e1.
El uso de nombres de marcas y fuentes comerciales se utiliza solamente para efectos de identificación y no constituye aval alguno por parte del Departamento de Salud y Servicios Humanos de los EE. UU.
Las referencias de sitios en Internet que no son de los CDC se ofrecen como un servicio a los lectores del MMWR y no constituyen ni implican el aval de estas organizaciones o sus programas por parte de los CDC o del Departamento de Salud y Servicios Humanos de los EE. UU. Los CDC no son responsables por el contenido de las páginas de estos sitios. Las direcciones URL enumeradas en el MMWR estaban actualizadas hasta la fecha de la publicación.
Todas las versiones HTML de los artículos del MMWR son generadas de pruebas finales a través de procesos automatizados. Esta conversión podría resultar en la traducción de caracteres o errores de formato en la versión HTML. Los usuarios deben remitirse a la versión en PDF (https://www.cdc.gov/mmwr) o a la copia original en papel del MMWR para obtener versiones para imprimir del texto, las cifras y las tablas oficiales.
Las preguntas o mensajes con respecto a errores en el formato deben dirigirse a mmwrq@cdc.gov.
Ayuda con los formatos de archivos:
¿Cómo se visualizan los diferentes formatos de archivos (PDF, DOC, PPT, MPEG) en este sitio?- Esta página fue revisada el 1 de agosto de 2017
- Esta página fue modificada el 1 de agosto de 2017
- Fuente del contenido:


 CompartirCompartir
CompartirCompartir