Descripción de 13 bebés que nacieron con infección congénita por el virus del Zika sin microcefalia al nacer entre octubre del 2015 y enero del 2016 - Brasil
Semanal / 2 de diciembre del 2016 / 65(47);1343-1348
Datos del artículo
Las vistas equivalen a las vistas de páginas más las descargas de PDFVistas:
Citas:
Métricas alternativas:
Detalles de la métricaEl 22 de noviembre del 2016, se dio a conocer este informe en línea como un adelanto del MMWR.
Vanessa van der Linden, MD1*; André Pessoa, MD2*; William Dobyns, MD3; A. James Barkovich, MD4; Hélio van der Linden Júnior, MD5; Epitacio Leite Rolim Filho, MD, PhD1,6; Erlane Marques Ribeiro, MD, PhD2; Mariana de Carvalho Leal, MD, PhD6,7; Pablo Picasso de Araújo Coimbra, MD8; Maria de Fátima Viana Vasco Aragão, MD, PhD9,10; Islane Verçosa, MD11; Camila Ventura, MD, PhD12,13; Regina Coeli Ramos, MD12; Danielle Di Cavalcanti Sousa Cruz, MD13; Marli Tenório Cordeiro, PhD14; Vivian Maria Ribeiro Mota15; Mary Dott, MD16; Christina Hillard, MA17; Cynthia A. Moore, MD, PhD17 (ver las afiliaciones de los autores)
Ver la referencia bibliográfica sugeridaResumen
¿Qué se sabe sobre este tema?
La infección congénita por el virus del Zika puede causar microcefalia y anormalidades cerebrales graves. A medida que haya más información disponible sobre el síndrome clínico relacionado, se amplía el fenotipo para incluir otras características, a menudo menos graves tales como las anormalidades cerebrales sin microcefalia congénita.
¿Qué información agrega este informe?
Si bien los bebés con infección congénita por el virus del Zika que tienen un tamaño de la cabeza normal han sido descritos ampliamente, falta una descripción más completa de las características del síndrome congénito por el virus del Zika en estos bebés. Este informe sobre 13 bebés con evidencia de laboratorio de infección congénita por el virus del Zika con tamaño de la cabeza normal al momento del nacimiento incluye los resultados de pruebas de diagnóstico por imágenes y de exámenes neurológicos, oftalmológicos, ortopédicos y de la audición. El seguimiento de estos bebés ha demostrado que en la mayoría de los casos la desaceleración del crecimiento de la cabeza ocurre al punto de la microcefalia después del nacimiento y se evidencian secuelas neurológicas importantes.
¿Cuáles son las consecuencias para la práctica de salud pública?
Se necesita más información para poder describir todo el espectro de hallazgos asociados con la infección congénita por el virus del Zika. No obstante, la microcefalia puede no ser evidente al nacer pero puede manifestarse posteriormente en bebés con anormalidades cerebrales subyacentes. Estos hallazgos recalcan la importancia de los estudios de neuroimagen tempranos en bebés expuestos al virus del Zika antes del nacimiento.
La infección congénita por el virus del Zika puede causar microcefalia y anormalidades cerebrales graves (1). El síndrome congénito asociado a la infección por el virus de Zika comprende un amplio espectro de características clínicas (2); sin embargo, como ocurre con la mayoría de los teratógenos recientemente reconocidos, se espera que el primer cuadro clínico documentado sea el más grave. Las primeras descripciones de los efectos de la infección por el virus del Zika in utero se centraban principalmente en el diagnóstico de microcefalia congénita (3). To assess the possibility of clinical presentations that do not include congenital microcephaly, a retrospective assessment of 13 infants from the Brazilian states of Pernambuco and Ceará with normal head size at birth and laboratory evidence of congenital Zika virus infection was conducted. Todos los bebés presentaban anormalidades cerebrales en los estudios de neuroimagen que concordaban con el síndrome congénito por el virus del Zika, incluido un volumen cerebral reducido, ventriculomegalia, calcificaciones subcorticales y malformaciones corticales. La primera evaluación se hizo al segundo día de vida. Se observó la desaceleración del crecimiento de las cabezas de los bebés desde edades tan cortas como los 5 meses. 11 bebés presentaron microcefalia. Estos hallazgos indican que entre los bebés con exposición prenatal al virus del Zika, la ausencia de microcefalia al nacer no excluye la infección congénita por el virus del Zika ni la presencia de anormalidades cerebrales asociadas al zika, entre otras. Estos hallazgos justifican la recomendación de hacer un seguimiento integral médico y del desarrollo de los bebés expuestos al virus del Zika antes del nacimiento. Las ecografías cerebrales tempranas pueden detectar anormalidades en el cerebro asociadas con la infección congénita por el virus del Zika incluso entre bebés con una circunferencia normal de la cabeza (4).
En este informe se incluyen trece bebés con evidencia de laboratorio de infección congénita por el virus del Zika y un tamaño normal de la cabeza al nacer (inferior o igual a 2 desviaciones estándar por debajo de la media para el sexo y la edad gestacional) (entre octubre del 2015 y enero del 2016). Los bebés fueron evaluados por equipos multidisciplinarios en dos centros de derivaciones en Brasil: Centro de Rehabilitación de la Asociación para la Asistencia de los Niños Discapacitados de Pernambuco, Recife, Estado de Pernambuco, y el Hospital Infantil Albert Sabin, Fortaleza, Estado de Ceará, durante los meses comprendidos entre octubre del 2015 y octubre del 2016.
Once de los bebés llamaron la atención clínica porque al nacer la circunferencia de la cabeza estaba por debajo del nivel establecido por el Ministerio de Salud de Brasil por lo que se solicitaron mayores evaluaciones ante una posible infección congénita por el virus del Zika (http://combateaedes.saude.gov.br/images/sala-de-situacao/Microcefalia-Protocolo-de-vigilancia-e-resposta-10mar2016-18h.pdf). This level was 33 cm before December 2, 2015, and 32 cm for gestational age ≥37 weeks after that date; however, all of these infants had head circumferences at birth that did not exceed 2 SD below the mean for gestational age, and therefore did not meet the definition for microcephaly (more than 2 SD below the mean). Estos 11 bebés fueron derivados para que se les hicieran evaluaciones neurológicas y estudios de neuroimagen. Los otros dos bebés que tenían circunferencias de cabeza dentro del rango normal al nacer fueron derivados para una evaluación neurológica a los 5 y 7 meses debido a preocupaciones en cuanto a su desarrollo.
Se utilizó un formulario estándar para recopilar datos demográficos y clínicos, incluso si las madres recordaban haber tenido un sarpullido durante el embarazo. Toda la información se obtuvo como parte de un protocolo clínico o como resultado de indicaciones clínicas. Se obtuvo el consentimiento informado para la recopilación, el uso y la publicación de fotografías clínicas de los bebés.
Evidencia de laboratorio de infección congénita por el virus del Zika se definió como resultados negativos en las pruebas de laboratorio para cinco causas infecciosas de microcefalia congénita (toxoplasmosis, citomegalovirus, rubéola, sífilis e infección por el virus de la inmunodeficiencia humana) y evidencia serológica de infección por el virus del Zika (resultado positivo en el ensayo de inmunoadsorción enzimática o MAC-ELISA para captura de anticuerpo de inmunoglobulina M [IgM] específico para el virus del Zika en líquido cefalorraquídeo [LCR] o suero del bebé). En la localidad de Recife, se hizo la prueba convencional de reacción en cadena de la polimerasa con transcriptasa inversa (RT-PCR) para detectar el ARN del virus del Zika y del dengue, y la prueba RT-PCR en tiempo real para el virus de chikunguña. La prueba RT-PCR Monoplex en tiempo real para el virus del Zika se hizo en la localidad de Fortaleza (5,6). Las pruebas realizadas a las madres para detectar evidencia de infección por el virus del Zika no estuvieron disponibles mientras transcurrían los 13 embarazos.
A los efectos de este informe, microcefalia se definió como una circunferencia de la cabeza (CC) (también conocida como circunferencia occipitofrontal) superior a 2 desviaciones estándar por debajo de la media para la edad gestacional y el sexo, según el Consorcio Internacional de Crecimiento Fetal y Neonatal para el Siglo XXI (INTERGROWTH-21st) (https://intergrowth21.tghn.org/) y los patrones de crecimiento infantil de la Organización Mundial de la Salud (www.who.int/childgrowth/en/). El peso al nacer se evaluó y clasificó como adecuado, bajo o alto para la edad gestacional y el sexo; también se utilizaron los patrones de INTERGROWTH-21st.
A todos los bebés se les realizaron evaluaciones neurológicas y ortopédicas, estudios de neuroimagen mediante tomografía computarizada sin contraste, resonancia magnética sin contraste, o ambos, y radiografías de la cadera para identificar la dislocación congénita. Además, todos los bebés fueron evaluados clínicamente sin instrumentos por disfagia por un terapeuta del habla; se les hizo una evaluación oftalmológica mediante oftalmoscopia; y a 11 de los 13 bebés se les hizo una evaluación de la audición (potenciales evocados auditivos de latencia corta del tronco cerebral [ABR] para aplicar estímulo) y pruebas de diagnóstico (ABR de confirmación con frecuencia específica para estímulos de tono puro) siguiendo la rutina recomendada por el Ministerio de Salud de Brasil y el Comité Conjunto para la Audición Infantil de American Academy of Pediatrics (7). A los bebés con sospecha clínica de tener actividad convulsiva se les hizo un electroencefalograma para confirmar el diagnóstico.
La serie de casos incluyó a nueve bebés de sexo masculino y cuatro de sexo femenino (Tabla 1). Once pacientes nacieron a término (gestación de 37 a 41 semanas) y dos nacieron antes de tiempo (gestación de 35 y 36 semanas). Seis de las 13 madres describieron haber tenido un sarpullido cutáneo entre el segundo y el quinto mes de embarazo. Todos los bebés nacieron con un peso adecuado para la edad gestacional (es decir, dentro de las 2 SD de la media para el sexo y la edad gestacional). La desproporción craniofacial se observó en seis bebés; tres tenían piel redundante en el cuero cabelludo al nacer. Tres bebés tenían displasia de cadera, incluido un bebé con artrogriposis quien tenía caderas bilateral dislocadas.
Todos los bebés dieron positivo en las pruebas de detección de IgM específica para el virus del Zika, tanto en LCR solamente (nueve bebés), en suero solamente (dos bebés) o LCR y suero (dos bebés). Los siete especímenes de LCR fueron analizados para detectar el ARN del virus del Zika mediante RT-PCR y todos dieron negativo; dos de estos bebés también dieron negativo en la prueba RT-PCR en suero recolectado junto con el LCR. Los resultados de las pruebas RT-PCR en los dos especímenes de suero solamente están pendientes. No se realizaron pruebas de detección del virus del Zika en orina. A la mayoría de los bebés (ocho de 13) se les hicieron las pruebas dentro del primer mes de vida; no obstante, se desconoce la fecha de la prueba de LCR de dos bebés. A tres bebés se les hicieron las pruebas de detección del virus del Zika fuera del periodo neonatal. Si bien se identificó al nacer por el tamaño de la cabeza, a un bebé no se les hicieron las pruebas hasta los 4 meses; a dos bebés se les hicieron las pruebas a los 5 y 7 meses cuando fueron examinados por primera vez por retraso en el desarrollo. Un bebé con resultado positivo en la prueba de IgM en LCR y suero al nacer dieron negativo en las nuevas pruebas en suero a los 6 meses de edad; otro dio positivo nuevamente en las nuevas pruebas a los 5 meses de edad.
Las circunferencias de la cabeza al nacer variaron de 0.3 a -2 SD de la media para el sexo y la edad gestacional (Tabla 1). Todos los bebés mostraron una disminución en la tasa de crecimiento de la circunferencia de la cabeza entre el nacimiento y la última evaluación. En 11 de 13 bebés, se diagnosticó microcefalia posnatal por presentar una medida de la circunferencia de la cabeza de más de 2 SD por debajo de la media para la edad y el sexo. Los estudios de neuroimagen (tomografía computarizada en 13 bebés y resonancia magnética en 10 bebés) mostraron malformaciones del desarrollo cortical, la cuales predominaron en su gran medida en sentido anterior; y calcificaciones, con predominio en la región subcortical (en especial en el área de transición entre la corteza y la materia blanca). Todos los estudios de neuroimagen mostraron evidencia de un volumen cerebral reducido, con ventriculomegalia en todos los bebés, y niveles elevados de líquido cefalorraquídeo en el espacio extraaxial en dos de los 13 bebés (Tabla 2) (imagen).
En la evaluación clínica se diagnosticó disfagia en 10 de 13 bebés. A siete bebés se les diagnosticó epilepsia. Cinco bebés mostraron cierto grado de irritabilidad, el cual mejoró a los 4 meses de edad. La mayoría de los bebés (12 de 13) manifestaron una buena interacción visual; un bebé no mostró contacto visual. Tres de los 13 bebés tenían anormalidades corioretinales. Los 11 bebés examinados mostraron valores auditivos normales. Todos los bebés presentaron cierto grado de hipertonía; 12 de 13 mostraron signos piramidales y extrapiramidales con movimiento distónico. Un bebé tuvo hemiparesia espástica y otro hemiparesia bilateral con mayor gravedad en el lateral izquierdo. Fue difícil evaluar a un bebé con artrogriposis por la tonicidad aumentada en algunos músculos y disminuida en otros. Nueve de 13 bebés no mostraron movimientos voluntarios en las manos y tenían reflejo de prensión. El buen control de la cabeza se observó en ocho de 13 bebés (material complementario en https://stacks.cdc.gov/view/cdc/42517).
Discusión
La microcefalia congénita ha sido un signo característico de la infección intrauterina por el virus del Zika. Sin embargo, a pesar de la ausencia de microcefalia al nacer, los 13 bebés descritos en este informe con evidencia de laboratorio de infección por el virus del Zika mostraron anormalidades cerebrales asociadas con el síndrome congénito de infección por el virus del Zika, incluyendo ventriculomegalia y volumen cerebral reducido, malformaciones subcorticales, lo que resaltó la importancia de los estudios de neuroimagen para evaluar a estos bebés. Además, algunos bebés presentaron otras anormalidades estructurales o funcionales que quizás llamó la atención médica más allá del tamaño de la cabeza. No obstante, estos hallazgos no se observaron con mayor frecuencia en los bebés con las circunferencias de cabeza más pequeñas. La infección congénita por el virus del Zika sin microcefalia al nacer se había reportado anteriormente (8), al igual que el desarrollo de microcefalia posnatal en bebés con presunta infección congénita (9). Sin embargo, este es el primer grupo de bebés con evidencia de laboratorio de infección congénita por el virus del Zika documentada que tiene crecimiento insatisfactorio de la cabeza con microcefalia en evolución después del nacimiento.
Las disminuciones en la tasa de crecimiento de la cabeza después del nacimiento en estos bebés estuvieron acompañadas por disfunción neurológica, incluyendo hipertonía y hemiparesia, disquinesia/distonía, disfagia, epilepsia y persistencia de reflejos primitivos. Si bien estos hallazgos neurológicos concuerdan con los informes previos de bebés con microcefalia congénita que tuvieron exposición prenatal al virus del Zika (2), los bebés que no tenían microcefalia al nacer mostraron una mejor interacción social (es decir, hicieron y mantuvieron contacto visual y mostraron una sonrisa social). No obstante, a más del 60% de los bebés en este grupo se les diagnosticó epilepsia (probablemente relacionada con las malformaciones corticales), y todos presentaron discapacidades motoras significativas que concuerdan con parálisis cerebral mixta (10). Los bebés eran demasiado pequeños para ser evaluados correctamente por déficits cognitivos.
Entre las seis madres que informaron sarpullido, cuatro dijeron haberlo tenido en el primer trimestre y dos en el segundo trimestre. Por lo tanto, entre estas madres, la aparición temprana de presunta infección durante el embarazo no resultó en el fenotipo más grave de infección congénita por el virus del Zika (es decir, microcefalia al nacer). Solo tres bebés tenían antecedentes de anormalidades prenatales detectadas mediante ecografías que concordaban con la infección congénita por el virus del Zika.
Se desconoce la patogénesis de la microcefalia posnatal como consecuencia de las infecciones por el virus del Zika. La disminución en el crecimiento de la cabeza podría ser la consecuencia de la destrucción in utero más temprana del neuroprogenitor u otras células neuronales, las moléculas que activan la respuesta inflamatoria persistente o la infección continua de las células neuronales. El último parece ser menos probable debido a los resultados negativos en las pruebas RT-PCR de detección del virus del Zika de las siete muestras de LCR analizadas.
Los resultados de este informe están sujetos al menos a cuatro limitaciones. En primer lugar, las mediciones de la circunferencia de la cabeza al nacer fueron registradas con una resolución de 0.5 cm (en contraposición a los 0.1 cm de costumbre), lo que probablemente resultó en una sobrestimación o infraestimación de la medida en algunos bebés. La circunferencia de la cabeza al nacer de dos bebés fue de 2 SD por debajo de la media o apenas inferior, y estas circunferencias podrían haberse clasificado incorrectamente dentro del rango normal. Además, los cálculos de SD pueden variar entre los patrones de crecimiento publicados para la circunferencia de la cabeza. En segundo lugar, los resultados de las pruebas de IgM para el zika no pudieron confirmarse mediante la prueba de neutralización por reducción en placas; por lo tanto, los bebés podrían haber sido clasificados incorrectamente debido a la reactividad cruzada con otros flavivirus o la reactividad no específica dentro del ELISA. En tercer lugar, con base en este grupo clínico solamente, no puede calcularse la prevalencia de síndrome congénito de infección por el virus del Zika al nacer sin microcefalia en la población. Por último, los cambios progresivos, como la tasa de pérdida de volumen cerebral, no pueden evaluarse debido a que no se recomienda hacer ecografías cerebrales en serie en bebés.
Se necesita más información para describir en detalle el espectro clínico de los hallazgos asociados a la infección congénita por el virus del Zika. Este informe revela que la microcefalia al nacer no es un signo característico esencial del síndrome congénito de infección por el virus del Zika. Los bebés con una circunferencia de la cabeza normal al nacer presentaban anormalidades cerebrales, entre otras, asociadas al síndrome congénito de infección por el virus del Zika y podrían desarrollar microcefalia con el paso del tiempo. Estos hallazgos demuestran la importancia de hacer estudios de neuroimagen tempranos a los bebés expuestos al virus del Zika antes del nacimiento y la necesidad de hacer un seguimiento médico y del desarrollo integral.
Autor responsable de la correspondencia: Cynthia A. Moore, zikamch@cdc.gov; 770-488-7100.
1Asociación para la Asistencia de los Niños Discapacitados, Recife, Pernambuco, Brasil; 2Hospital Infantil Albert Sabin, Fortaleza, Ceará, Brasil; 3University of Washington y Seattle Children's Research Institute, Seattle; 4University of California-San Francisco; 5Centro de Rehabilitación Dr. Henrique Santillo, Goiania, Brasil; 6Universidad Federal de Pernambuco, Recife, Pernambuco, Brasil; 7Hospital Agamenon Magalhães (HAM), Recife, Pernambuco Brasil; 8Uniclinic Diagnóstico por Imagem, Fortaleza, Brasil; 9Centro Diagnóstico Multimagem, Recife, Pernambuco, Brasil; 10Universidad Mauricio de Nassau, Recife, Pernambuco, Brasil; 11Caviver Clinical, Fortaleza, Ceará, Brasil; 12Fundación Altino Ventura, Recife, Pernambuco, Brasil; 13Centro Oftalmológico de Pernambuco, Recife, Pernambuco, Brasil; 12Hospital de la Universidad Oswaldo Cruz, Recife, Pernambuco, Brasil; 13Instituto Integral de Medicina Profesor Fernando Figueira, Recife, Pernambuco, Brasil; 14Centro de Pesquisas Aggeu Magalhães-Fiocruz, Recife, Pernambuco, Brasil; 15Universidad de Fortaleza, Fortaleza, Brasil; 16Centro de Vigilancia, Epidemiología y Servicios de Laboratorio , CDC; 17Centro Nacional de Defectos Congénitos y Deficiencias del Desarrollo, CDC.
* Estos autores también contribuyeron con este informe.
Referencias
- de Araújo TV, Rodrigues LC, de Alencar Ximenes RA, et al. Association between Zika virus infection and microcephaly in Brazil, January to May, 2016: preliminary report of a case-control study. Lancet Infect Dis 2016. Epub September 15, 2016. PubMed
- Moore CA, Staples JE, Dobyns WB, et al. Characterizing the pattern of anomalies in congenital Zika syndrome for pediatric clinicians. JAMA Pediatr 2016. CrossRef PubMed
- Schuler-Faccini L, Ribeiro EM, Feitosa IM, et al. Possible association between Zika virus infection and microcephaly-Brazil, 2015. MMWR Morb Mortal Wkly Rep 2016;65:59-62. CrossRef PubMed
- Russell K, Oliver SE, Lewis L, et al. Update: interim guidance for the evaluation and management of infants with possible congenital Zika virus infection-United States, August 2016. MMWR Morb Mortal Wkly Rep 2016;65:870-8. CrossRef PubMed
- Lanciotti RS, Calisher CH, Gubler DJ, Chang GJ, Vorndam AV. Detección rápida y tipificación de los virus del dengue a partir de muestras clínicas usando la reacción en cadena de la polimerasa con transcriptasa inversa. J Clin Microbiol 1992;30:545-51. PubMed
- Lanciotti RS, Kosoy OL, Laven JJ, et al. Genetic and serologic properties of Zika virus associated with an epidemic, Yap State, Micronesia, 2007. Emerg Infect Dis 2008;14:1232-9. CrossRef PubMed
- American Academy of Pediatrics, Joint Committee on Infant Hearing. Year 2007 position statement: principles and guidelines for early hearing detection and intervention programs. Pediatrics 2007;120:898-921. CrossRef PubMed
- França GV, Schuler-Faccini L, Oliveira WK, et al. Congenital Zika virus syndrome in Brazil: a case series of the first 1501 livebirths with complete investigation. Lancet 2016;388:891-7. CrossRef PubMed
- Moura da Silva AA, Ganz JSS, Sousa PD, et al. Early growth and neurologic outcomes of infants with probable congenital Zika virus syndrome. Emerg Infect Dis 2016;22:1953-6. CrossRef PubMed
- Wimalasundera N, Stevenson VL. Cerebral palsy. Pract Neurol 2016;16:184-94. CrossRef PubMed
 TABLA 1. Historia clínica y hallazgos físicos de 13 bebés con infección congénita por el virus del Zika sin microcefalia al nacer - Brasil, octubre del 2015 a octubre del 2016
TABLA 1. Historia clínica y hallazgos físicos de 13 bebés con infección congénita por el virus del Zika sin microcefalia al nacer - Brasil, octubre del 2015 a octubre del 2016
| N.° de paciente | Sexo | Edad gestacional (semanas) | Peso al nacer (gm) | Anormalidades observadas en ecografías prenatales informadas* | Sarpullido materno | ELISA para anticuerpo IgM contra el virus del Zika en bebés | HC (cm) y SD† al nacer | Edad (meses) del último seguimiento | HC (cm) y SD§ de seguimiento | Hallazgos oculares¶ | Desproporción craniofacial al nacer** | Artrogriposis o displasia de cadera al nacer†† |
|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 1 | F | 35 | 2 570 | no | 3 meses. | LCR, suero + | 29.5 (-1.72) | 11 | 39 (-3.86) | no | sí | no |
| 2 | M | 38 | 3 125 | sí | 2 meses. | LCR + | 33 (-0.4) | 10 | 41 (-3.33) | sí | no | sí |
| 3 | M | 39 | 2 770 | no | ninguno | LCR, suero + | 32 (-1.63) | 11 | 43 (-2.11) | no | no | no |
| 4 | M | 37 | 2 785 | sí | 2 meses. | LCR + | 31 (-1.65) | 10 | 43 (-1.98) | no | sí | no |
| 5 | F | 37 | 2 465 | sí | 5 meses. | LCR + | 31 (-1.39) | 12 | 36 (-6.18) | no | sí | no |
| 6 | M | 39 | 2 975 | no | 4 meses. | LCR + | 33 (-0.78) | 11 | 42 (-2.89) | no | no | no |
| 7 | M | 39 | 3 840 | no | ninguno | LCR + | 33 (-0.78) | 12 | 40 (-4.68) | no | sí | sí |
| 8 | F | 41 | 2 955 | no | ninguno | LCR + | 32 (-1.95) | 9 | 39.5 (-3.17) | no | no | sí |
| 9 | M | 39 | 3 155 | no | 3 meses. | LCR + | 33.5 (-0.35) | 11 | 42.5 (-2.5) | no | no | no |
| 10 | M | 40 | 3 100 | no | ninguno | LCR + | 32 (-2) | 10 | 40 (-4.27) | sí | sí | sin datos |
| 11 | M | 38 | 2 965 | no | ninguno | LCR + | 33.5 (0.02) | 7 | 40 (-2.98) | no | no | sin datos |
| 12 | F | 36 | 2 930 | no | ninguno | suero + | 32.5 (0.3) | 7 | 40.5 (-1.35) | no | no | no |
| 13 | M | 40 | 2 990 | no | ninguno | suero + | 33 (-1.16) | 5 | 40 (-2.12) | sí | sí | no |
Abreviaturas: LCR = líquido cefalorraquídeo; ELISA = ensayo de inmunoadsorción enzimática; F = femenino; HC = circunferencia de la cabeza; IgM = inmunoglobulina M; M = masculino; SD = desviación estándar.
* Las anormalidades incluyen calcificaciones cerebrales (paciente 2), microcefalia (paciente 4) y volumen cerebral reducido con ventriculomegalia (paciente 5).
† Las desviaciones estándar se calcularon con la aplicación de la herramienta para el tamaño del recién nacido INTERGROWTH-21st (https://intergrowth21.tghn.org/global-perinatal-package/intergrowth-21st-comparison-application/).
§ Las desviaciones estándar se calcularon con PediTools según los patrones de crecimiento de la Organización Mundial de la Salud para los 0 a 24 meses de edad. (http://peditools.org/growthwho/index.php).
¶ Las anormalidades incluyen atrofia coriorretiniana macular en el ojo derecho (paciente 2), atrofia coriorretiniana macular discreta en el ojo izquierdo (paciente 10) y atrofia macular en el ojo izquierdo (paciente 13).
** Las anormalidades incluyen cuero cabelludo redundante (pacientes 5, 10, 13).
†† Las anormalidades incluyen artrogriposis (paciente 2), displasia de cadera (pacientes 2, 7, 8) y debilidad diafragmática (paciente 2).
 TABLA 2. Resultados de las ecografías cerebrales realizadas mediante tomografías computarizada (TC) y resonancia magnética (RM) de 13 bebés con infección congénita por el virus del Zika sin microcefalia al nacer - Brasil, octubre del 2015 a octubre del 2016
TABLA 2. Resultados de las ecografías cerebrales realizadas mediante tomografías computarizada (TC) y resonancia magnética (RM) de 13 bebés con infección congénita por el virus del Zika sin microcefalia al nacer - Brasil, octubre del 2015 a octubre del 2016
| N.° de paciente | Tipo de imágenes* (edad) | Volumen cerebral reducido | Malformaciones del desarrollo cortical | Lóbulos más afectados† | Hipoplasia cerebelosa o tronco cerebral | Hipoplasia del cuerpo calloso† | Ventriculomegalia | Niveles elevados de LCR en el espacio extraaxial | Calcificaciones§ |
|---|---|---|---|---|---|---|---|---|---|
| 1 | TC (1 mes) RM (4 meses) | sí | sí | derecho, posterior | sí | sí | sí | no | subcorticales y ganglios basales |
| 2 | TC (1 semana) RM (2 meses) | sí | sí | bilateral, difuso | sí | no | sí | no | subcorticales, ganglios basales |
| 3 | TC (2 días) RM (1 semana) | sí† | sí† | derecho, difuso | no | sí | sí | no | subcorticales |
| 4 | TC (1 día) RM (7.5 meses) | sí | sí | desconocido | sí | desconocido | sí | no | subcorticales y ganglios basales |
| 5 | TC (3 días) RM (12 meses) | sí | sí | bilateral, difuso | sí | sí | sí | sí | subcorticales y ganglios basales |
| 6 | TC (3 días) RM (3.5 meses) | no | sí† | bilateral, anterior | no | sí | sí | no | subcorticales |
| 7 | TC (2 semanas) RM (9 meses) |
sí | sí | bilateral, difuso | no | sí | sí | sí | subcorticales |
| 8 | TC (2 meses) | sí | sí | desconocido | no | sí | sí | no | subcorticales y ganglios basales |
| 9 | TC (3 días) RM (6 meses) |
sí | sí | bilateral, anterior | no | no | no | no | subcorticales |
| 10 | TC (3 meses) | sí | sí | bilateral, difuso | no | no evaluado | sí | no | ganglios basales |
| 11 | TC (7 meses) | sí | sí | bilateral, difuso | no | no evaluado | sí | sí | subcorticales |
| 12 | TC (1 mes) RM (9 meses) | sí | sí | bilateral, difuso | no | sí | no | no | subcorticales |
| 13 | TC (2 mes) RM (11 meses) | sí | sí | bilateral, difuso | no | sí | sí | no | subcorticales |
Abreviaturas: TC = tomografía computarizada; RM = resonancia magnética.
* Los resultados de los bebés evaluados mediante TC y RM coinciden a menos que se indique lo contrario.
† Con base en RM.
§ Con base en TC.
 FIGURA. Fotografías clínicas e imágenes de resonancia magnética (RM) y tomografía computarizada (TC) de dos bebés con síndrome asociado a la infección congénita por el virus del Zika* - Brasil, octubre del 2015 a octubre del 2016
FIGURA. Fotografías clínicas e imágenes de resonancia magnética (RM) y tomografía computarizada (TC) de dos bebés con síndrome asociado a la infección congénita por el virus del Zika* - Brasil, octubre del 2015 a octubre del 2016
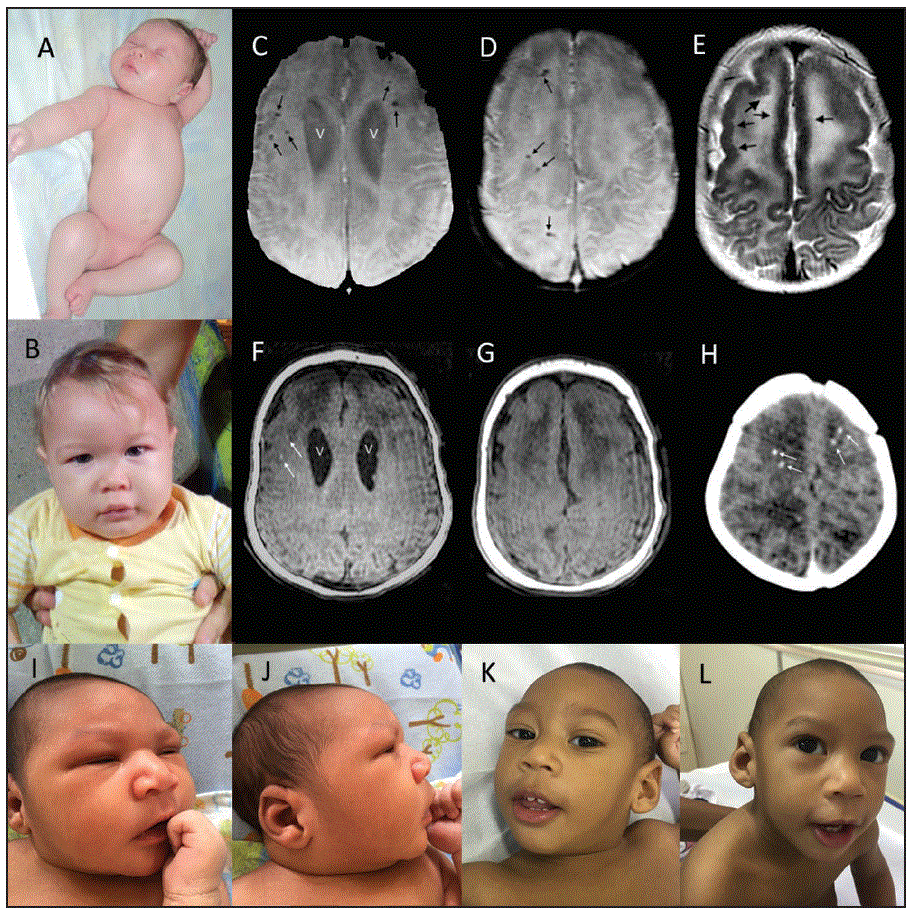
*A. Un recién nacido (paciente 6 en la Tabla 2) sin anomalías distinguibles, incluida la ausencia de desproporción craniofacial y extremidades normales. B. Mismo bebé a los 11 meses con circunferencia de la cabeza en casi 3 desviaciones estándar por debajo de la media sin anomalías craneofaciales aparentes. C.D. Las imágenes axiales ponderadas en susceptibilidad a los 3.5 meses muestran ventrículos laterales más grandes (V) y múltiples calcificaciones (flechas negras pequeñas). E. La imagen ponderada en T2 muestra corteza frontal engrosada con sulcación frontal reducida. Irregularidades menores de las superficies corticales internas de los lóbulos frontales (flechas negras), que concuerdan con polimicrogiria. F.G. En las imágenes ponderadas en T1, los ventrículos (V) son apenas más visibles y dos de las calcificaciones más grandes (flechas blancas) se observan como áreas de hiperintensidad. H. La tomografía axial computarizada sin contraste de una exploración anterior a los 3 días muestra manchas estriadas a partir del movimiento del paciente y múltiples calcificaciones de materia blanca en la parte frontal (flechas blancas). I.J. Recién nacido (paciente 7 en la Tabla 2) con regiones frontales apenas deprimidas y frente inclinada observadas en I., pero menos evidentes en J., vista lateral. K.L. A los 12 meses, las fotografías muestran claramente signos de microcefalia, pero también un bebé interactivo con buen contacto visual.
Cita sugerida para este artículo: van der Linden V, Pessoa A, Dobyns W, et al. Description of 13 Infants Born During October 2015-January 2016 With Congenital Zika Virus Infection Without Microcephaly at Birth - Brazil. Informe Semanal de Morbilidad y Mortalidad (MMWR) 2016;65:1343–1348. DOI: http://dx.doi.org/10.16/mmwr.mm6547e2.
El uso de nombres de marcas y fuentes comerciales se utiliza solamente para efectos de identificación y no constituye aval alguno por parte del Departamento de Salud y Servicios Humanos de los EE. UU.
Las referencias de sitios en Internet que no son de los CDC se ofrecen como un servicio a los lectores del MMWR y no constituyen ni implican el aval de estas organizaciones o sus programas por parte de los CDC o del Departamento de Salud y Servicios Humanos de los EE. UU. Los CDC no son responsables por el contenido de las páginas de estos sitios. Las direcciones URL enumeradas en el MMWR estaban actualizadas hasta la fecha de la publicación.
Todas las versiones HTML de los artículos del MMWR son generadas de pruebas finales a través de procesos automatizados. Esta conversión podría resultar en la traducción de caracteres o errores de formato en la versión HTML. Los usuarios deben remitirse a la versión en PDF (https://www.cdc.gov/mmwr) o a la copia original en papel del MMWR para obtener versiones para imprimir del texto, las cifras y las tablas oficiales.
Las preguntas o mensajes con respecto a errores en el formato deben dirigirse a mmwrq@cdc.gov.
Ayuda con los formatos de archivos:
¿Cómo se visualizan los diferentes formatos de archivos (PDF, DOC, PPT, MPEG) en este sitio?- Esta página fue revisada el 14 de agosto de 2017
- Esta página fue modificada el 14 de agosto de 2017
- Fuente del contenido:


 CompartirCompartir
CompartirCompartir