Evaluaciones de donaciones de sangre para prevenir infecciones por el virus del Zika - Puerto Rico, 3 de abril - 11 de junio del 2016
Semanal / 24 de junio de 2016 / 65(24)
Datos del artículo
Las vistas equivalen a las vistas de páginas más las descargas de PDFVistas:
Citas:
Métricas alternativas:
Detalles de la métricaEl 17 de junio del 2016, se dio a conocer este informe en línea como un adelanto del MMWR.
Matthew J. Kuehnert1; Sridhar V. Basavaraju1; Robin R. Moseley1; Lisa L. Pate2; Susan A. Galel2; Phillip C. Williamson3; Michael P. Busch4; Jose O. Alsina5; Consuelo Climent-Peris6; Peter W. Marks7; Jay S. Epstein7; Hira L. Nakhasi7; J. Peyton Hobson7; David A. Leiby7; Pradip N. Akolkar7; Lyle R. Petersen1; Brenda Rivera-Garcia8 (ver las afiliaciones de los autores)
Ver la referencia bibliográfica sugeridaSe han registrado contagios por transfusión de sangre por varios arbovirus como el virus del Nilo Occidental y del dengue (1). Se determinó que el virus del Zika, un flavivirus que se transmite principalmente por los mosquitos Aedes aegypti, causante de la microcefalia congénita y otros defectos graves en el cerebro (2), es una potencial amenaza para la seguridad sanguínea tras conocer los informes del brote del 2013–2014 en la Polinesia Francesa. Las inquietudes relacionadas con la seguridad sanguínea se deben a la alta incidencia de contagio en la población en general durante las epidemias, el alto porcentaje de personas con una infección asintomática, el gran porcentaje de donaciones de sangre con pruebas detectadas de ácido nucleico de virus del Zika en análisis retrospectivos y un periodo de viremia de aproximadamente 7 a 10 días (3). Se ha registrado al menos un caso de contagio del virus del Zika por transfusión de sangre en Brasil después de la aparición del virus, posiblemente en el 2014 (4). Seguidamente, se produjo una rápida diseminación epidémica del virus en otras áreas de las Américas, tales como Puerto Rico.
En febrero del 2016, la Administración de Alimentos y Medicamentos (FDA) publicó recomendaciones para las pruebas de evaluación y el diferimiento de donantes y el manejo de productos para reducir el riesgo de infección por transfusión de sangre del virus del Zika en los Estados Unidos y sus territorios (5). Además de los cuestionarios sobre el comportamiento y el riesgo de salud para los donantes de sangre en todas las áreas, la FDA recomienda el diferimiento para los donantes en áreas no afectadas que recientemente han visitado o han vivido en un área con transmisión activa del virus del Zika a través de mosquitos. Para los centros donde se extrae sangre en áreas con transmisión activa a través de mosquitos como Puerto Rico y otros territorios de los EE. UU., las recomendaciones incluyen dejar de tomar muestras de sangre e importar las unidades de sangre de áreas no afectadas del territorio continental de los Estados Unidos, a menos que se implemente una de las siguientes opciones: 1) evaluación del virus del Zika de las donaciones de sangre extraída a nivel local o 2) tratamiento de unidades extraídas a nivel local con tecnología de reducción de microbios patógenos (FDA para el tratamiento de plasma y plaquetas obtenidas por aféresis). En Puerto Rico, en un principio las intervenciones se limitaban a la importación de unidades sanguíneas de áreas no efectadas de los EE. UU. y al tratamiento de plasma y plaquetas obtenidas por aféresis con tecnología de reducción de microbios patógenos; las pruebas de detección del virus del Zika no estaban disponibles. El 3 de abril del 2016, se implementaron evaluaciones del virus del Zika de las donaciones de sangre extraída a nivel local a través de las nuevas prueba de detección de ácido nucleico (NAT, por sus siglas en inglés) (cobas Zika, Roche Molecular Systems, Inc., Pleasanton, California) autorizadas por la FDA conforme a la solicitud de un nuevo fármaco en investigación (IND, por sus siglas en inglés) (6). Como parte del IND, las muestras de plasma de los donantes de sangre son evaluadas individualmente y los especímenes con resultados de reactivos están sujetos a pruebas de detección adicionales que incluyen NAT y estudios serológicos de inmunoglobulina M. Una donación de sangre con resultado inicial de reactivos de NAT es considerada como presunto donante de sangre virémico que indica que el donante está infectado y por lo tanto es eliminado del banco de sangre.
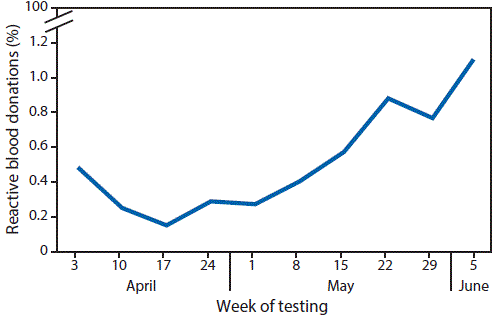
Entre el 3 de abril y el 11 de junio del 2016, se detectó un total de 68 (0.5%) presuntos donantes virémicos de 12 777 donaciones evaluadas. La incidencia semanal más alta fue del 1.1% para la última semana de informes, del 5 al 11 de junio, y la incidencia ha ido in crescendo con el paso del tiempo. (imagen).
Aunque la población de donantes de sangre de Puerto Rico no pretende ser representativa de la población en general desde el punto de vista estadístico, la prevalencia cada vez mayor de ácido nucleico de virus del Zika entre los donantes de sangre posiblemente refleja un aumento en la incidencia de infecciones en la población en general. Según los datos de los brotes anteriores causados por los arbovirus transmitidos por el mosquito Aedes aegypti, la alta incidencia que suele asociarse a estos brotes puede generar que un porcentaje considerable de la población corra riesgo de contagiarse. Por ejemplo, el virus del chikunguña ingresó a Puerto Rico en 2014. La evaluación retrospectiva para la detección del ácido nucleico de virus del Zika se realizó en donaciones de sangre extraída durante junio y diciembre del 2014, y la viremia promedio detectable fue del 0.65%, con un pico de 2.1% en octubre. Testing for chikungunya virus immunoglobulin M antibody of retained individual blood donation samples obtained during March 1–9, 2015, suggested that nearly 25% of the Puerto Rico population became infected during the previous year’s epidemic (7). Debido a que la viremia solo se manifiesta en los días posteriores a una infección grave, los anticuerpos de immunoglobulina M pueden ofrecer un cálculo más preciso de la carga de la infección reciente. Los datos sobre el virus del chikunguña del 2014–2015 indican que la detección de la viremia en un porcentaje relativamente menor de donantes de sangre cada semana puede reflejar que un porcentaje importante de la población en general se infecta durante el transcurso de una temporada de epidemia.
Actualmente no hay medicamento o vacuna disponible para tratar o prevenir la enfermedad por el virus del Zika. La prevención se centra en evitar las picaduras de mosquitos, eliminar los sitios donde se crían los mosquitos, controlar la población de mosquitos en la comunidad y tomar las medidas necesarias para prevenir la trasmisión sexual del virus. Las evaluaciones del banco de sangre de EE. UU. que utilizan pruebas de detección de ácido nucleico han reducido notoriamente el riesgo de transmisión por transfusión por varios patógenos, que incluye el virus del Nilo Occidental después de haber sido asociado a las epidemias de los arbovirus en los Estados Unidos. Se espera que las medidas para proteger el banco de sangre del virus del Zika, que incluyen el deferimiento de donantes, evaluación en laboratorio y la reducción de microbios patógenos, reduzcan del mismo modo el riesgo de transmisión por transfusión de sangre.
Autor responsable de la correspondencia: Matthew J. Kuehnert, eocevent281@cdc.gov, 800-232-4636.
1Equipo de seguridad sanguínea en respuesta al virus del Zika, CDC; 2Roche Molecular Systems, Inc., Pleasanton, California; 3Creative Testing Solutions, Tempe, Arizona; 4Blood Systems Research Institute, San Francisco, California; 5Banco de Sangre de Servicios Mutuos, San Juan, Puerto Rico; 6Banco de Sangre de Puerto Rico; 7Administración de Alimentos y Medicamentos (FDA), Silver Spring, Maryland; 8Departamento de Salud de Puerto Rico.
Referencias
- Petersen LR, Busch MP. Transfusion-transmitted arboviruses. Vox Sang 2010;98:495-503. CrossRef PubMed
- Rasmussen SA, Jamieson DJ, Honein MA, Petersen LR. Zika virus and birth defects-reviewing the evidence for causality. N Engl J Med 2016;374:1981-7. CrossRef PubMed
- Lanteri MC, Kleinman SH, Glynn SA, et al. Zika virus: a new threat to the safety of the blood supply with worldwide impact and implications. Transfusion 2016. Publicación electrónica 9 de junio del 2016. CrossRef PubMed
- Barjas-Castro ML, Angerami R, Cunha M, et al. Probable transfusion-transmitted Zika virus in Brazil. Transfusion 2016. En imprenta.
- Food and Drug Administration. Recommendations for donor screening, deferral, and product management to reduce the risk of transfusion-transmission of Zika virus. Silver Spring, MD: US Department of Health and Human Services, Food and Drug Administration; 2016. http://www.fda.gov/downloads/BiologicsBloodVaccines/GuidanceComplianceRegulatoryInformation/Guidances/Blood/UCM486360.pdf
- Food and Drug Administration. FDA allows use of investigational test to screen blood donations for Zika virus. Silver Spring, MD: US Department of Health and Human Services, Food and Drug Administration; 2016. http://www.fda.gov/NewsEvents/Newsroom/PressAnnouncements/ucm493081.htm
- Simmons G, Brès V, Lu K, et al. High incidence of chikungunya virus frequency of viremic blood donations during epidemic, Puerto Rico, USA, 2014. Emerg Infect Dis 2016;22:1221-8. Publicación electrónica - Abril del 2016. CrossRef PubMed
 FIGURA. Proporción de donaciones de sangre evaluadas con reactivos para detectar la infección por el virus del Zika - Puerto Rico, 3 de abril - 11 de junio del 2016
FIGURA. Proporción de donaciones de sangre evaluadas con reactivos para detectar la infección por el virus del Zika - Puerto Rico, 3 de abril - 11 de junio del 2016
Citación sugerida para este artículo: Kuehnert MJ, Basavaraju SV, Moseley RR, et al. Screening of Blood Donations for Zika Virus Infection - Puerto Rico, April 3-June 11, 2016. MMWR Morb Mortal Wkly Rep 2016;65. DOI: http://dx.doi.org/10.16/mmwr.mm6524e2.
El uso de nombres de marcas y fuentes comerciales se utiliza solamente para efectos de identificación y no constituye aval alguno por parte del Departamento de Salud y Servicios Humanos de los EE. UU.
Las referencias de sitios en Internet que no son de los CDC se ofrecen como un servicio a los lectores del MMWR y no constituyen ni implican el aval de estas organizaciones o sus programas por parte de los CDC o del Departamento de Salud y Servicios Humanos de los EE. UU. Los CDC no son responsables por el contenido de las páginas de estos sitios. Las direcciones URL enumeradas en el MMWR estaban actualizadas hasta la fecha de la publicación.
Todas las versiones HTML de los artículos del MMWR son generadas de pruebas finales a través de procesos automatizados. Esta conversión podría resultar en la traducción de caracteres o errores de formato en la versión HTML. Los usuarios deben remitirse a la versión en PDF (https://www.cdc.gov/mmwr) o a la copia original en papel del MMWR para obtener versiones para imprimir del texto, las cifras y las tablas oficiales.
Las preguntas o mensajes con respecto a errores en el formato deben dirigirse a mmwrq@cdc.gov.
Ayuda con los formatos de archivos:
¿Cómo se visualizan los diferentes formatos de archivos (PDF, DOC, PPT, MPEG) en este sitio?- Esta página fue revisada el 29 de agosto de 2017
- Esta página fue modificada el 29 de agosto de 2017
- Fuente del contenido:


 CompartirCompartir
CompartirCompartir