குளோரைட்டு
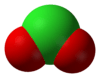
குளோரைட்டு (Chlorite) எதிர்மின் அயனியின் மூலக்கூற்றுவாய்ப்பாடு ClO−2 ஆகும். இந்த எதிர்மின் அயனியில் குளோரின் +3 என்ற ஆக்சிசனேற்ற நிலையில் உள்ளது. குளோரைட்டு என்ற எதிர்மின் அயனியைக் கொண்டுள்ள எந்த வேதிச் சேர்மத்தையும் ஒரு குளோரைட்டு என்று வரையறுக்கலாம். குளோரசு அமிலத்தின் உப்புகள் அனைத்தும் பொதுவாக குளோரைட்டுகள் என்றழைக்கப்படுகின்றன.
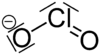 | |
 | |
| பெயர்கள் | |
|---|---|
| ஐயூபிஏசி பெயர்
குளோரைட்டு | |
| இனங்காட்டிகள் | |
| 14998-27-7 | |
| ChemSpider | 170734 |
| EC number | 215-285-9 |
InChI
| |
| யேமல் -3D படிமங்கள் | Image |
| பப்கெம் | 197148 |
SMILES
| |
| பண்புகள் | |
| ClO− 2 | |
| வாய்ப்பாட்டு எடை | 67.452 |
மாறுதலாக ஏதும் சொல்லவில்லை என்றால் கொடுக்கப்பட்ட தரவுகள் யாவும் பொருள்கள் அவைகளின் இயல்பான வெப்ப அழுத்த நிலையில் (25°C, 100kPa) இருக்கும். | |
| Infobox references | |
சேர்மங்கள்
தனி அமிலமான குளோரசு அமிலம் (HClO2) என்பதே குறைந்த நிலைப்புத் தன்மை கொண்ட குளோரினின் ஆக்சோ அமிலத்திற்கு எடுத்துக்காட்டாகும். குறைவான அடர்த்தியுடன் ஒரு நீரிய கரைசலாக மட்டுமே இது அறியப்படுகிறது. இந்த அமிலத்தை ஓர் அடர் அமிலமாக மாற்ற இயலாது என்பதால் இச்சேர்மம் எந்தவிதமான வர்த்தக முக்கியத்துவத்தையும் பெறவில்லை. கார உலோகங்கள் மற்றும் காரமண் உலோகங்களின் சேர்மங்கள் அனைத்தும் நிறமற்றோ அல்லது வெளிர் மஞ்சள் நிறத்திலோ நிறங்கொண்டு காணப்படுகின்றன. சோடியம் குளோரைட்டு மட்டுமே (NaClO2) வர்த்தக முக்கியத்துவம் பெற்ற ஒரேயொரு குளோரைட்டு சேர்மமாகும். கன உலோக குளோரைட்டுகள் (Ag+, Hg+, Tl+, Pb2+, Cu2+ மற்றும் NH+4) போன்றவையும் நிலைப்புத்தன்மை இல்லாதவைகளாகும். மேலும் இவை வெப்பம் அல்லது அதிர்ச்சியால் கூட வெடித்தலுடன் சிதைவடைகின்றன [1].
சோடியம் குளோரேட்டிலிருந்து (NaClO3) மறைமுகமாக சோடியம் குளோரைட்டு சேர்மம் வருவிக்கப்படுகிறது. முதலில் வெடிக்கும் தன்மை கொண்ட நிலைப்புத்தன்மை இல்லாத குளோரின் டையாக்சைடு ClO2 வாயு உற்பத்தி செய்யப்படுகிறது. இதற்காக சோடியம் குளோரேட்டு சேர்மத்துடன் வலிமையான ஓர் அமிலக் கரைசல் சேர்க்கப்பட்டு அதனுடன் ஒரு பொருத்தமான ஒடுக்கும் முகவர் சேர்த்து அவ்வினை கலவை ஒடுக்குதல் வினைக்கு உட்படுத்தப்படுகிறது. சோடியம் குளோரைடு, கந்தக டை ஆக்சைடு அல்லது ஐதரோகுளோரிக் அமிலம் போன்ற ஒடுக்கும் முகவர்களில் ஒன்று இவ்வினைக்காகப் ஒடுக்கியாகப் பயன்படுத்தப்படுகிறது.
கட்டமைப்பும் பண்புகளும்
குளோரின் அணுவின் மீதுள்ள தனி இணை எலக்ட்ரான்களின் வேதியியல் விளைவுகள் காரணமாக வளைவான மூலக்கூற்று வடிவியலை குளோரைட்டு அயனி ஏற்றுக் கொள்கிறது. O–Cl–O பிணைப்பின் பிணைப்புக் கோணம் 111 பாகைகளாகும். இதேபோல Cl–O பிணைப்பின் பிணைப்பு நீளம் 156 பைக்கோ மீட்டர்களாகும் [1]. குளோரினின் ஆக்சி எதிர்மின் அயனிகளில் குளோரைட்டு அயனியே வலிமையான ஆக்சிசனேற்றி வகையாகும். நிலையான அரை செல் கட்டமைப்பின் ஆற்றல் வளத்தின் அடிப்படையிலேயே இதை வலிமையான ஆக்சிசனேற்றி என்று கூறுகிறார்கள் [2].
| அயனி | அமில வினை | எலக்ட்ரான்'° (வோல்ட்டு) | நடுநிலை/கார வினை | எலக்ட்ரான்'° (வோல்ட்டு) |
|---|---|---|---|---|
| ஐப்போகுளோரைட்டு | H+ + HOCl + e− → 1⁄2 Cl2(g) + H2O | 1.63 | ClO− + H2O + 2 e− → Cl− + 2 OH− | 0.89 |
| குளோரைட்டு | 3 H+ + HOClO + 3 e− → 1⁄2 Cl2(g) + 2 H2O | 1.64 | ClO− 2 + 2 H2O + 4 e− → Cl− + 4 OH− | 0.78 |
| குளோரேட்டு | 6 H+ + ClO− 3 + 5 e− → 1⁄2 Cl2(g) + 3 H2O | 1.47 | ClO− 3 + 3 H2O + 6 e− → Cl− + 6 OH− | 0.63 |
| பெர்குளோரேட்டு | 8 H+ + ClO− 4 + 7 e− → 1⁄2 Cl2(g) + 4 H2O | 1.42 | ClO− 4 + 4 H2O + 8 e− → Cl− + 8 OH− | 0.56 |
பயன்கள்
குளோரைட்டுகளில் மிகவும் முக்கியமான குளோரைட்டாகக் கருதப்படும் சேர்மம் சோடியம் குளோரைட்டு (NaClO2) சேர்மம் ஆகும். நெசவுத் தொழிலில் துணிகள், பசைகள், காகிதம் போன்றவற்றை வெளுக்க சோடியம் குளோரைட்டு பயன்படுத்தப்படுகிறது. இருப்பினும் இது வலுவான ஆக்சிசனேற்ற தன்மை கொண்டு இருந்தபோதிலும் நடுநிலை இனங்களான குளோரின் டை ஆக்சைடு (ClO2) போன்ற சேர்மத்தை உருவாக்க இது பெரும்பாலும் நேரடியாகப் பயன்படுத்தப்படுவதில்லை, பொதுவாக ஐதரசன் குளோரைடு (HCl) உடனான வினை வழியாக உருவாக்கப்படுகிறது.
- 5 NaClO2 + 4 HCl → 5 NaCl + 4 ClO2 + 2 H2O
பிற ஆக்சியெதிர்மின் அயனிகள்
குளோரினுக்கு பல்வேறு ஆக்சியெதிர்மின் அயனிகள் உள்ளன. அவற்றில் தொடர்புள்ள எதிர்மின் அயனிகளுடன் குளோரின் −1, +1, +3, +5, அல்லது +7 என்ற ஆக்சிசனேற்ற நிலைகளில் காணப்படுகிறது. குளோரின் (Cl−) ஐப்போகுளோரைட்டு (ClO−), குளோரைட்டு (ClO−2), குளோரேட்டு (ClO−3) மற்றும் பெர்குளோரேட்டு (ClO−4) என்ற குளோரைட்டுகள் பொதுவாக அறியப்படுகின்றன. குளோரின் ஆக்சைடுகள் என்ற பெரிய சேர்மங்களின் குழுவில் இதுவும் ஒரு பகுதியாகும்.
| ஆக்சிசனேற்ற நிலை | −1 | +1 | +3 | +5 | +7 |
|---|---|---|---|---|---|
| பெயரிடப்பட்ட எதிர்மின் அயனி | குளோரைட்டு | ஐப்போகுளோரைட்டு | குளோரைட்டு' | குளோரேட்டு | பெர்குளோரேட்டு |
| வாய்ப்பாடு | Cl− | ClO− | ClO− 2 |
ClO− 3 |
ClO− 4 |
| கட்டமைப்பு |  |
 |
 |
மேற்கோள்கள்
- Greenwood, N.N.; Earnshaw, A. (2006). Chemistry of the elements (2nd ). Oxford: Butterworth-Heinemann. பக். 861. பன்னாட்டுத் தரப்புத்தக எண்:0750633654.
- Cotton, F. Albert; Wilkinson, Geoffrey (1988), Advanced Inorganic Chemistry (5th ), New York: Wiley-Interscience, p. 564, பன்னாட்டுத் தரப்புத்தக எண்:0-471-84997-9