হিস্টোন
জীববিজ্ঞানে, ইউক্যারয়োটিক প্রাণীকোষের নিউক্লাইয়ে প্যাকেজ হয়ে ডিএনএর গাঠনিক একককে সুষমভাবে রাখা উচ্চ এলকালাইন প্রোটিন পাওয়া যায়, এদের হিস্টোন বলে।[1][2] ক্রোমাটিনের প্রধান প্রোটিন অংশ হিসেবে ডিএনএন কে আবদ্ধ করে রাখতে , জিন রেগুলেশনে হিস্টোন অবদান রাখে। হিস্টোনের অনুপস্থিতিতে ক্রোমোজোমের দৈর্ঘ্য অনেক লম্বা হত। মানবদেহে প্রায় ১.৮ মিটার দৈর্ঘ্যের ২৩ জোড়া ক্রোমোজম। হিস্টোন না থাকলে ৯০ মাইক্রোমিটার ক্রোমাটিন মাইটোসিস প্রক্রিয়ায় প্রতিরূপ তৈরি করে প্রায় ১২০ মাইক্রোমিটার দৈর্ঘের ক্রোমোজোম তৈরি করতো।[3]
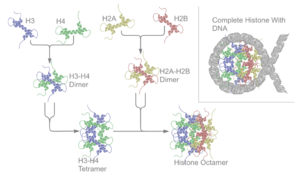
শ্রেণী ও হিস্টোনের প্রকারভেদ
প্রধান পাঁচ হিস্টোন পরিবার এখন পর্যন্ত পাওয়া যায়। এরা হচ্ছে- H1/H5, H2A, H2B, H3, and H4.[4][5][6] হিস্টোন এইচ২এ (H2A),এইচ২বি (H2B),এইচ৩(H3) এবং এইচ৪(H4) প্রধান বা কোর হিস্টোন নামে পরিচিত। হিস্টোন এইচ১/এইচ৫(H1/H5) লিংকার হিস্টোন বলা হয়।
মানবদেহের হিস্টোন প্রোটিনের তালিকা লিপিবদ্ধ করা হল:
| বৃহৎ পরিবার | পরিবার | সাব-পরিবার | সদস্য |
|---|---|---|---|
| লিংকার | H1 | H1F | H1F0, H1FNT, H1FOO, H1FX |
| H1H1 | HIST1H1A, HIST1H1B, HIST1H1C, HIST1H1D, HIST1H1E, HIST1H1T | ||
| প্রধান বা কোর | H2A | H2AF | H2AFB1, H2AFB2, H2AFB3, H2AFJ, H2AFV, H2AFX, H2AFY, H2AFY2, H2AFZ |
| H2A1 | HIST1H2AA, HIST1H2AB, HIST1H2AC, HIST1H2AD, HIST1H2AE, HIST1H2AG, HIST1H2AI, HIST1H2AJ, HIST1H2AK, HIST1H2AL, HIST1H2AM | ||
| H2A2 | HIST2H2AA3, HIST2H2AC | ||
| H2B | H2BF | H2BFM, H2BFS, H2BFWT | |
| H2B1 | HIST1H2BA, HIST1H2BB, HIST1H2BC, HIST1H2BD, HIST1H2BE, HIST1H2BF, HIST1H2BG, HIST1H2BH, HIST1H2BI, HIST1H2BJ, HIST1H2BK, HIST1H2BL, HIST1H2BM, HIST1H2BN, HIST1H2BO | ||
| H2B2 | HIST2H2BE | ||
| H3 | H3A1 | HIST1H3A, HIST1H3B, HIST1H3C, HIST1H3D, HIST1H3E, HIST1H3F, HIST1H3G, HIST1H3H, HIST1H3I, HIST1H3J | |
| H3A2 | HIST2H3C | ||
| H3A3 | HIST3H3 | ||
| H4 | H41 | HIST1H4A, HIST1H4B, HIST1H4C, HIST1H4D, HIST1H4E, HIST1H4F, HIST1H4G, HIST1H4H, HIST1H4I, HIST1H4J, HIST1H4K, HIST1H4L | |
| H44 | HIST4H4 |
ইতিহাস
১৮৮৪ সালে বিজ্ঞানী আলব্রেখট কোসেল হিস্টোনের অস্তিত্ব আবিষ্কার করেন। ১৯শতকে জার্মান শব্দ "হিস্টোন" থেকে এর নামকরণ করা হয়, যা মূলতঃ গ্রীক শব্দ হিস্টানি বা হিস্টোস থেকে এসেছে।
অন্যান্য ক্ষেত্র
ডিএনএ ক্ষতি
হিস্টনের পরিবর্তন ডিএনএর গাঠনিক পরিবর্তনে বিশেষ ভূমিকা রাখে। এছাড়াও অতিবেগুনী রশ্মি হতে ডিএনএর সুরক্ষা হিস্টোন নিশ্চিত করে।
- সেরিন ১৩৯serine 139 (γH2AX) তে এইচ২এ এক্স (H2AX) এর ফসফোরাইলেশন
- গামা এইচ২এএক্স (gamma H2AX) নামে পরিচিত একটি ডিএনএ ডাবল স্ট্র্যান্ড ব্রেক মার্কার,[7] ডিএনএ ক্ষতিগ্রস্থ হওয়ার ফলে তৈরি হয়।[8] ডিএনএ ডাবল স্ট্র্যান্ডে ভাঙ্গন ধরার আদি পর্যায়ে এইচ২এএক্স এর ফসফোরাইলেশন শুরু হয়। [7][9][10] এটি পরীক্ষিত যে,[11] গামা এইচ২এএক্স জিনোমের স্থায়িত্ব ধরে রাখতে ভূমিকা পালন করে।[11][12]
- এইচ৩লাইসিন৫৬(H3K56Ac)-এর এসিটাইলেশন
- এইচ৩লাইসি২৬এসিএক্স জিনোমের স্থায়ীত্বের জন্য গুরুত্বপূর্ন।[13][14] p300/Rtt109 কমপ্লেক্স দ্বারা এইচ৩লাইসি২৬এসিএক্স (H3K56) এসিটাইলেটেড হয়। [15][16][17] কিন্তু ডিএনএ ক্ষতিগ্রস্থ হওয়ার কাছাকাছি এলাকায় আবার ডিএসিটাইলেটেড হয়। ফলে গুরুত্বপূর্ন "ফোর্ক এর দূর্যোগ ঘটে না।[18][19] ফাঞ্জাই এর ডিএনএ রেপ্লিকেশনে এইচ৩লাইসি২৬এসিএক্স এন্টিবায়োটিক উন্নতিকে লক্ষ্য করে গুরুত্বপূর্ন ভূমিকা পালন করে।[20]
আরোও দেখুন
তথ্যসূত্র
- Youngson RM (২০০৬)। Collins Dictionary of Human Biology। Glasgow: HarperCollins। আইএসবিএন 0-00-722134-7।
- Cox M, Nelson DR, Lehninger AL (২০০৫)। Lehninger Principles of Biochemistry। San Francisco: W.H. Freeman। আইএসবিএন 0-7167-4339-6।
- Redon C, Pilch D, Rogakou E, Sedelnikova O, Newrock K, Bonner W (এপ্রিল ২০০২)। "Histone H2A variants H2AX and H2AZ"। Current Opinion in Genetics & Development। 12 (2): 162–9। doi:10.1016/S0959-437X(02)00282-4। PMID 11893489।
- "Histone Variants Database 2.0"। National Center for Biotechnology Information। সংগ্রহের তারিখ ১৩ জানুয়ারি ২০১৭।
- Bhasin M, Reinherz EL, Reche PA (২০০৬)। "Recognition and classification of histones using support vector machine"। Journal of Computational Biology। 13 (1): 102–12। doi:10.1089/cmb.2006.13.102। PMID 16472024।
- Hartl DL, Freifelder D, Snyder LA (১৯৮৮)। Basic Genetics। Boston: Jones and Bartlett Publishers। আইএসবিএন 0-86720-090-1।
- Rogakou EP, Pilch DR, Orr AH, Ivanova VS, Bonner WM (মার্চ ১৯৯৮)। "DNA double-stranded breaks induce histone H2AX phosphorylation on serine 139"। The Journal of Biological Chemistry। 273 (10): 5858–68। doi:10.1074/jbc.273.10.5858। PMID 9488723।
- Celeste A, Petersen S, Romanienko PJ, Fernandez-Capetillo O, Chen HT, Sedelnikova OA, Reina-San-Martin B, Coppola V, Meffre E, Difilippantonio MJ, Redon C, Pilch DR, Olaru A, Eckhaus M, Camerini-Otero RD, Tessarollo L, Livak F, Manova K, Bonner WM, Nussenzweig MC, Nussenzweig A (মে ২০০২)। "Genomic instability in mice lacking histone H2AX"। Science। 296 (5569): 922–7। doi:10.1126/science.1069398। PMID 11934988। পিএমসি 4721576

- Shroff R, Arbel-Eden A, Pilch D, Ira G, Bonner WM, Petrini JH, Haber JE, Lichten M (অক্টো ২০০৪)। "Distribution and dynamics of chromatin modification induced by a defined DNA double-strand break"। Current Biology। 14 (19): 1703–11। doi:10.1016/j.cub.2004.09.047। PMID 15458641।
- Rogakou EP, Boon C, Redon C, Bonner WM (সেপ্টে ১৯৯৯)। "Megabase chromatin domains involved in DNA double-strand breaks in vivo"। The Journal of Cell Biology। 146 (5): 905–16। doi:10.1083/jcb.146.5.905। PMID 10477747। পিএমসি 2169482

- Stewart GS, Wang B, Bignell CR, Taylor AM, Elledge SJ (ফেব্রু ২০০৩)। "MDC1 is a mediator of the mammalian DNA damage checkpoint"। Nature। 421 (6926): 961–6। doi:10.1038/nature01446। PMID 12607005।
- Bekker-Jensen S, Mailand N (ডিসে ২০১০)। "Assembly and function of DNA double-strand break repair foci in mammalian cells"। DNA Repair। 9 (12): 1219–28। doi:10.1016/j.dnarep.2010.09.010। PMID 21035408।
- Ozdemir A, Spicuglia S, Lasonder E, Vermeulen M, Campsteijn C, Stunnenberg HG, Logie C (জুলাই ২০০৫)। "Characterization of lysine 56 of histone H3 as an acetylation site in Saccharomyces cerevisiae"। The Journal of Biological Chemistry। 280 (28): 25949–52। doi:10.1074/jbc.C500181200। PMID 15888442।
- Masumoto H, Hawke D, Kobayashi R, Verreault A (জুলাই ২০০৫)। "A role for cell-cycle-regulated histone H3 lysine 56 acetylation in the DNA damage response"। Nature। 436 (7048): 294–8। doi:10.1038/nature03714। PMID 16015338।
- Driscoll R, Hudson A, Jackson SP (ফেব্রু ২০০৭)। "Yeast Rtt109 promotes genome stability by acetylating histone H3 on lysine 56"। Science। 315 (5812): 649–52। doi:10.1126/science.1135862। PMID 17272722। পিএমসি 3334813

- Han J, Zhou H, Horazdovsky B, Zhang K, Xu RM, Zhang Z (ফেব্রু ২০০৭)। "Rtt109 acetylates histone H3 lysine 56 and functions in DNA replication"। Science। 315 (5812): 653–5। doi:10.1126/science.1133234। PMID 17272723।
- Das C, Lucia MS, Hansen KC, Tyler JK (মে ২০০৯)। "CBP/p300-mediated acetylation of histone H3 on lysine 56"। Nature। 459 (7243): 113–7। doi:10.1038/nature07861। PMID 19270680। পিএমসি 2756583

- Han J, Zhou H, Li Z, Xu RM, Zhang Z (সেপ্টে ২০০৭)। "Acetylation of lysine 56 of histone H3 catalyzed by RTT109 and regulated by ASF1 is required for replisome integrity"। The Journal of Biological Chemistry। 282 (39): 28587–96। doi:10.1074/jbc.M702496200। PMID 17690098।
- Wurtele H, Kaiser GS, Bacal J, St-Hilaire E, Lee EH, Tsao S, Dorn J, Maddox P, Lisby M, Pasero P, Verreault A (জানু ২০১২)। "Histone H3 lysine 56 acetylation and the response to DNA replication fork damage"। Molecular and Cellular Biology। 32 (1): 154–72। doi:10.1128/MCB.05415-11। PMID 22025679। পিএমসি 3255698

- Wurtele H, Tsao S, Lépine G, Mullick A, Tremblay J, Drogaris P, Lee EH, Thibault P, Verreault A, Raymond M (জুলাই ২০১০)। "Modulation of histone H3 lysine 56 acetylation as an antifungal therapeutic strategy"। Nature Medicine। 16 (7): 774–80। doi:10.1038/nm.2175। PMID 20601951। পিএমসি 4108442
