ফসফরিক অ্যাসিড
অর্থো ফসফরিক এসিড বা ফসফোরিক (৫) এসিড। একটি অজৈব খনিজ দুর্বল এসিড যার রাসায়নিক সংকেত H3PO4। অর্থোফসফরিক এসিডের অণুসমূহ পরস্পর সন্নিবেশিত হয়ে বিভিন্ন ধরনের যৌগ তৈরী করে যেগুলো ফসফরিক এসিড নামেই পরিচিত। ফসফরিক এসিড বলতে মূলত অর্থোফসফরিক এসিডকে বোঝানো। ফসফরিক এসিড অবিষাক্ত এবং কক্ষ তাপমাত্রা ও চাপে কঠিন পদার্থ।
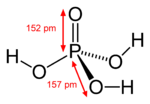 | |
| নামসমূহ | |
|---|---|
| ইউপ্যাক নাম
ট্রাইহাইড্রোঅক্সাইডোঅক্সাইডো ফসফরাস (trihydroxidooxidophosphorus) ফসফরিক এসিড (phosphoric acid) | |
| অন্যান্য নাম
Orthophosphoric acid trihydroxylphosphine oxide | |
| শনাক্তকারী | |
সিএএস নম্বর |
|
ত্রিমাত্রিক মডেল (জেমল) |
|
| সিএইচইবিআই | |
| সিএইচইএমবিএল | |
| কেমস্পাইডার | |
| ইসিএইচএ ইনফোকার্ড | ১০০.০২৮.৭৫৮ |
| ইসি-নম্বর | 231-633-2 |
| ই নম্বর | E৩৩৮ (অ্যান্টিঅক্সিডেন্ট, ...) |
| কেইজিজি | |
পাবকেম CID |
|
| আরটিইসিএস নম্বর | TB6300000 |
| ইউএনআইআই | |
| ইউএন নম্বর | 1805 |
ইনকি
| |
এসএমআইএলইএস
| |
| বৈশিষ্ট্য | |
| H3O4P | |
| আণবিক ভর | ৯৭.৯৯ g·mol−১ |
| বর্ণ | white solid or colourless, viscous liquid (>42 °C) deliquescent |
| গন্ধ | odorless |
| ঘনত্ব | 1.885 g/mL (liquid) 1.685 g/mL (85% solution) 2.030 g/mL (crystal at 25 °C) |
| গলনাঙ্ক | ৪২.৩৫ °সে (১০৮.২৩ °ফা; ৩১৫.৫০ K) (anhydrous) ২৯.৩২ °সে (৮৪.৭৮ °ফা; ৩০২.৪৭ K) (hemihydrate) |
| স্ফুটনাঙ্ক | ১৫৮ °সে (৩১৬ °ফা; ৪৩১ K) ২১৩ °সে (৪১৫ °ফা; ৪৮৬ K) decomposes |
পানিতে দ্রাব্যতা |
392.2 g/100 g (−16.3 °C) 369.4 g/100 mL (0.5 °C) 446 g/100 mL (14.95 °C) miscible (42.3 °C)[1] |
| দ্রাব্যতা | soluble in ethanol |
| বাষ্প চাপ | 0.03 mmHg (20°C)[2] |
| অম্লতা (pKa) | 1 = 2.148 2 = 7.198 3 = 12.319 |
| প্রতিসরাঙ্ক (nD) | 1.34203 |
| সান্দ্রতা | 2.4–9.4 cP (85% aq. soln.) 147 cP (100%) |
| গঠন | |
| স্ফটিক গঠন | monoclinic |
| তাপ রসায়নবিদ্যা | |
| স্ট্যন্ডার্ড মোলার এন্ট্রোফি এস |
158 J/mol•K[3] |
| গঠনে প্রমান এনথ্যাল্পির পরিবর্তন ΔfH |
-1288 kJ/mol[3] |
| ঝুঁকি প্রবণতা | |
| জিএইচএস চিত্রলিপি |  |
| জিএইচএস সাংকেতিক শব্দ | Corrosive |
| জিএইচএস বিপত্তি বিবৃতি | H290, H314[4] |
| জিএইচএস সতর্কতামূলক বিবৃতি | P280, P305+351+338, P310[4] |
ইইউ শ্রেণীবিভাগ (ডিএসডি) |
|
| আর-বাক্যাংশ | আর৩৪ |
| এস-বাক্যাংশ | (এস১/২), এস২৬, এস৪৫ |
| এনএফপিএ ৭০৪ | 
0
3
0 |
| ফ্ল্যাশ পয়েন্ট | Non-flammable |
| প্রাণঘাতী ডোজ বা একাগ্রতা (LD, LC): | |
LD৫০ (মধ্যমা ডোজ) |
1530 mg/kg (rat, oral)[5] |
| যুক্তরাষ্ট্রের স্বাস্থ্য অনাবৃতকরণ সীমা (NIOSH): | |
PEL (অনুমোদনযোগ্য) |
TWA 1 mg/m3[2] |
REL (সুপারিশকৃত) |
TWA 1 mg/m3 ST 3 mg/m3[2] |
IDLH (তাৎক্ষণিক বিপদ |
1000 mg/m3[2] |
| সম্পর্কিত যৌগ | |
| Related {{{label}}} | {{{value}}} |
সুনির্দিষ্টভাবে উল্লেখ করা ছাড়া, পদার্থসমূহের সকল তথ্য-উপাত্তসমূহ তাদের প্রমাণ অবস্থা (২৫ °সে (৭৭ °ফা), ১০০ kPa) অনুসারে দেওয়া হয়েছে। | |
| তথ্যছক তথ্যসূত্র | |
বিক্রিয়া
আর্দ্র ফসফরিক এসিড কম গলনাঙ্কবিশিষ্ট সাদা কঠিন পদার্থ। বায়ুশূণ্য অবস্থায় ৮৫% ফসফরিক এসিডকে ডিহাইড্রেশান করলে এটি পাওয়া যায়।[6]
অর্থোফসফরিক এসিড পোলারধর্মী। এটি পানিতে দ্রবণীয়। অর্থো এবং অন্যান্য ফসফরিক এসিডে ফসফরাস এর জারণ অবস্থা +৫।
পানির সাথে ফসফরিক এসিডের প্রদেয় বিক্রিয়া:
- H3PO4(s) + H2O(l)

- H2PO4−(aq)+ H2O(l)

- HPO42−(aq)+ H2O(l)

ব্যবহার
ফসফরাস এসিডের প্রধানত ব্যবহৃত হয় সার শিল্পে।[7]
খাদ্য উপাদান হিসেবে
কোলা এবং বেভারেজ জাতীয় পানীয়কে অম্লীয় করতে ফুড-গ্রেড ফসফরিক এসিড ব্যবহার করা হয়।[8] এটা টক বা ঝাঁঝালো স্বাদ তৈরী করে।
জৈবিক প্রতিক্রিয়া
কোমল পানীয়ে
ফসফরিক এসিড অনেক কোলা জাতীয় কোমল পানীয় ব্যবহার করা হয়। এর ফলে কিডনি সংক্রমণ এবং হাড়ের ঘনত্ব ক্ষয় পাওয়ার মত রোগের উপদ্রব দেখা দেয়। যুক্তরাষ্ট্রের ন্যাশনাল ইনস্টিটিউট অব এনভায়রনমেন্টাল হেলথ সার্ভিসের এপিডার্মিয়োলজি শাখা এক গবেষণার ফলাফলে জানিয়েছে, এক দিনে দুই বা তার অধিক কোলা পান ক্রোনিক কিডনি রোগের ঝুঁকি দ্বিগুণ বাড়িয়ে দেয়।[9]
তথ্যসূত্র
- Seidell, Atherton; Linke, William F. (১৯৫২)। [Google Books Solubilities of Inorganic and Organic Compounds]
|ইউআরএল=এর মান পরীক্ষা করুন (সাহায্য)। Van Nostrand। সংগ্রহের তারিখ ২০১৪-০৬-০২। - "NIOSH Pocket Guide to Chemical Hazards #0506" (ইংরেজি ভাষায়)। ন্যাশনাল ইনস্টিটিউট ফর অকুপেশনাল সেফটি অ্যান্ড হেলথ (NIOSH)।
- Zumdahl, Steven S. (২০০৯)। Chemical Principles 6th Ed.। Houghton Mifflin Company। পৃষ্ঠা A22। আইএসবিএন 0-618-94690-X।
- Sigma-Aldrich Co., Phosphoric acid. Retrieved on 2014-05-09.
- "Phosphoric acid"। স্বাস্থ্য এবং জীবনের জন্য সহসা ঝুঁকিপূর্ণ। National Institute for Occupational Safety and Health (NIOSH)।
- Klement, R. (1963) "Orthophosphoric Acid" in Handbook of Preparative Inorganic Chemistry, 2nd ed., G. Brauer (ed.), Academic Press, NY. Vol. 1. p. 543.
- Klaus Schrödter, Gerhard Bettermann, Thomas Staffel, Friedrich Wahl, Thomas Klein, Thomas Hofmann "Phosphoric Acid and Phosphates" in Ullmann's Encyclopedia of Industrial Chemistry 2008, Wiley-VCH, Weinheim.
- "Current EU approved additives and their E Numbers"। Foods Standards Agency। ১৪ মার্চ ২০১২। সংগ্রহের তারিখ ২২ জুলাই ২০১২।
- PMID 17525693 (PubMed)
কয়েক মিনিটের মধ্যে স্বয়ংক্রিয়ভাবে উদ্ধৃতি সম্পন্ন করা হবে। Jump the queue বা expand by hand
বহিঃসংযোগ
| উইকিমিডিয়া কমন্সে ফসফরিক অ্যাসিড সংক্রান্ত মিডিয়া রয়েছে। |