بونڈ انرجی
علم کیمیا میں بونڈ انرجی (یعنی بندھن کی توانائ) سے مراد حرارت کی وہ مقدار ہوتی ہے جو کسی سالمے ( molecules) کی مخصوص تعداد کو جدا جدا ایٹموں میں تبدیل کر دے۔ یہ مخصوص تعداد 6.02214179×1023 مالیکیول ہے جسے ایک Mole کہا جاتا ہے۔
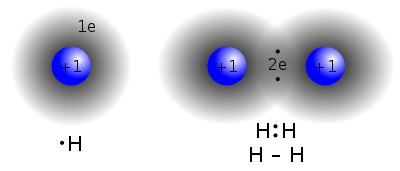
جب دو یا زیادہ ایٹم آپس میں مل کر متحد ہوتے ہیں تو ان کے بیرونی ترین الیکٹرانوں کے اتحاد سے ایک کیمیائ بونڈ (chemical bond) وجود میں آتا ہے۔ جب بھی کوئی کیمیائ بونڈ بنتا ہے تو توانائ یا حرارت خارج ہوتی ہے اور نیا مرکب (یا کمپاونڈ) بنتا ہے۔ اگر یہ خارج شدہ حرارت دوبارہ مل جائے تو یہ کیمیائ بونڈ حرارت جذب کر کے ٹوٹ جاتا ہے اور ایٹم پھر سے جدا جدا ہو جاتے ہیں۔ کیمیائ بونڈ جتنا مضبوط ہو گا بونڈ انرجی بھی اتنی ہی زیادہ ہو گی اور بننے والے مولیکیول میں ایٹموں کا درمیانی فاصلہ بھی اتنا ہی کم ہو گا۔
قدرتی گیس میتھین methane کے ہر مولیکیول میں پانچ ایٹم ہوتے ہیں جو چار کیمیائ بونڈ سے آپس میں جڑے ہوئے ہوتے ہیں۔ ان پانچوں ایٹموں کو الگ الگ کرنے کے لیے کل 396 کلو کیلوری فی مول کی ضرورت ہوتی ہے۔ یعنی ایک کاربن ہائیڈروجن بونڈ توڑنے کے لیے اوسطاً 99 کلو کیلوری کی ضرورت ہوتی ہے جو اس بونڈ کی بونڈ انرجی ہے۔
بونڈ انرجی Bond-dissociation energy کا اوسط ہوتی ہے۔
کیمیائ بونڈ کی اقسام
ایٹم کے بیرونی ترین الیکٹران آپس میں مل کر تین طرح کے بونڈ بناتے ہیں یعنی آئیونک بونڈ، کوویلنٹ بونڈ اور کوآرڈینیٹ کویلنٹ بونڈ اس طرح مولیکیول وجود میں آتے ہیں۔ مولیکیول بھی ایک دوسرے کے لیے کشش رکھتے ہیں جس سے تین طرح کے مزید بونڈ بن سکتے ہیں جو ,Non polar interactions, Polar interactions اور Hydrogen bonds کہلاتے ہیں۔
کیمیایئ بونڈ میں
- covalent bond مضبوط ترین بونڈ ہوتے ہیں۔ سنگل کویلینٹ بونڈ کی بونڈ انرجی 60 سے 110 کلو کیلوری فی مول ہوتی ہے جبکہ ڈبل کی 150 اور ٹرپل کی 200 ہوتی ہے۔
- ionic bond اس سے کافی کمزور ہوتا ہے اور اس کی بونڈ انرجی 4 سے 8 کلو کیلوری فی مول ہوتی ہے۔
- hydrogen bond کی بونڈ انرجی 4 سے 5 کلو کیلوری فی مول ہوتی ہے۔
- polar interaction کی بونڈ انرجی 2 سے 3 کلو کیلوری فی مول ہوتی ہے۔
- non polar interaction یا hydrophobic interaction کی بونڈ انرجی ایک کلو کیلوری فی مول ہوتی ہے۔
کوویلنٹ بونڈ کی اقسام سنگل کوویلنٹ بونڈ ڈبل کوویلنٹ بونڈ ٹرپل کوویلنٹ بونڈ
| Bond | Bond | Bond-dissociation energy | Comment | |
|---|---|---|---|---|
| (kcal/mole) | (kJ/mole) | |||
| C-H | C-H bond | 98 | 410 | C-H bond strength affected by substituents (see next table) |
| C-F | C-F bond | 117 | 490 | one of the strongest single bonds to carbon |
| C-Cl | C-Cl bond | 79 | 331 | more labile than C-H and C-F bonds, chlorocarbons degrade photochemically |
| C-Br | C-Br bond | 69 | 285 | weaker than C-Cl bonds bromocarbons are often labile and are useful fire retardants |
| C-C | C-C bond | 83-85 | 348-356 | strong, but weaker than C-H bonds, routinely broken by thermal cracking |
| Cl-Cl | chlorine | 58 | 242 | indicated by the yellowish colour of this gas |
| Br-Br | برومین | 46 | 192 | indicated by the brownish colour of Br2 source of the Br. radical |
| I-I | iodine | 36 | 151 | indicated by the purplish colour of I2 source of the I. radical |
| H-H | hydrogen | 104 | 436 | strong, nonpolarizable bond cleaved only by metals and by strong oxidants |
| O-H | hydroxyl | 110 | 460 | comparable to strength of O=O and C-H bonds |
| O=O | آکسیجن | 119 | 497 | strong bond, but O-H bonds are of comparable strength |
| N≡N | nitrogen | 226 | 945 | نائٹروجن (N2) کے مولیکیول میں بے حد مضبوط ٹرپل بونڈ ہوتا ہے اس لیے نائٹروجن کے مولیکیول کو توڑ کر امونیا بنانے میں بڑی توانائی خرچ کرنی پڑتی ہے۔ |