ரூதர்போர்டு அணுமாதிரி
ரூதர்போர்டு அணுமாதிரி (Rutherford model, ரதர்போர்டு மாதிரி) என்பது எர்ணஸ்ட் ரதர்ஃபோர்டு என்பவர் முன்வைத்த ஓர் அணு மாதிரியாகும். ரூதர்போர்டின் மேற்பார்வையில் 1909 ஆம் ஆண்டில் நடத்தப்பட்ட பிரபலமான கைகர்-மார்சுடன் பரிசோதனை முடிவுகளின் அடிப்படையில் ஜெ. ஜெ. தாம்சன் 1898 இல் முன்வைத்த அணுமாதிரி தவறானதென்று 1911 இல் கூறினார்.[1]
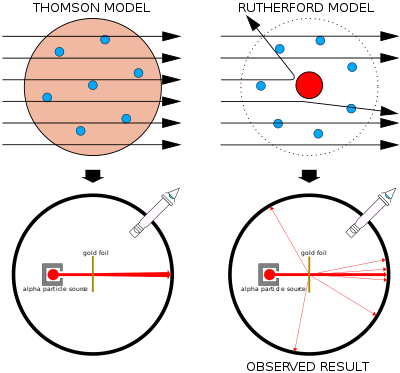
இடது பக்கம்: எதிர்பார்க்கப்பட்ட விளைவு: அல்பா துகள்கள் தாம்சன் அணுவை துளைத்துகொண்டு செல்லும்.
வலது பக்கம்: சோதனையின் கண்ட முடிவு: சில அல்பா துகள்கள் நேரெதிராக பிரதிபலிக்கப்பட்டது, இதற்கு அணுவின் மையத்தில் நேர்மின்சுமை குவிந்திருக்க வேண்டும்.
அறிமுகம்
பத்தொன்பதாம் நூற்றாண்டில் அறிவியல் ஆய்வாளர்கள் அணுவை ஏற்றுகொண்ட போதிலும், அணுவை பற்றி மேலும் எதனையும் அவர்கள் அறியவில்லை. எதிர்மின்னிகள் கண்டுபிடிக்கபட்ட பின்னர், அணுவின் அமைப்பைப் பற்றி அறியும் ஆவல் அதிகமாக ஆகியது. எதிர் மின்துகளோ எதிர் மின்சுமை கொண்டது, ஆனால் அணுவோ மின் தன்மை அற்றது. இதன் காரணமாக நேர்மின் சுமை கொண்ட துகள் அணுவில் இருக்கவேண்டும் என எண்ணினர். மேலும் எதிர் மின்துகள்கள் அணுகளை விட மிகவும் குறைந்த நிறை கொண்டிருந்தது. இதனால் அணுவின் பெரும்பாலான நிறை அதன் நேர்மின் சுமை கொண்ட துகள் கொண்டிருக்கவேண்டும் என்று கருதினர்.[2]:103
தாம்சன் அணுமாதிரி
இதனை மையமாக கொண்டு J J தாம்சன் 1898-ம் ஆண்டு ஒரு அனுமதிரியை முன்மொழியிந்தார். அதுவே தாம்சன் அணுமாதிரி என்று அழைக்கபட்டது.[2]:103 இவ்வணுமாதிரியில் அணு என்பது ஒரு நேர்மின்சுமை கொண்ட கோளம் போன்றும் அதில் எதிமின் சுமை கொண்ட எதிர் மின் துகள்கள் புதைந்திருந்ததாகவும் சொல்லபட்டிருந்தது. அன்றைய காலகட்டத்தில் அனைவரையும் கவர்ந்த மாதிரி அது. இவ்வாறே பதிமூன்று ஆண்டுகள் கழிந்தன.
கைகர்-மார்சுடன் பரிசோதனை
1911-ம் ஆண்டு கேய்கேர் (Geiger) மற்றும் மர்ச்டேன் (Marsden) ஆகிய இருவரும் ரூதர்போர்டின் சொல்படி சோதனை செய்தனர். அவர்கள் அல்பா துகள்களை அணுவின் இடையே செல்ல செய்வதே ஆகும். இதற்கு அவர்கள் ஒரு கதிரியக்க தனிமத்தை கொண்டு சோதனை செய்தனர். இந்த தனிமதிலிருந்து வெளியாகும் அல்பா துகள்களை ஒரு துளை வழியாக செலுத்தினர். இந்த அல்பா துகள்கள் ஒரு ஒளிக்கோடு (beam) போன்று மறு பக்கம் சென்று ஒருமெல்லிய தங்க தகட்டின் வழியே பாய்ந்து மறுபக்க துத்தநாக திரையை சென்றடைந்தன. இந்த துத்தநாக திரையில் அல்பா துகள்கள் படும் பொழுது ஒளிர்வத்தை காணலாம். இந்த சோதனையில் தாம்சன் அணுமாதிரி கொண்டு நடத்தப்பட்டதால், சோதனையில் பெரும்பாலான அல்பா துகள்கள் நேராக சென்று துத்தநாக திரையை அடையும் எனவும் எஞ்சியவை நேரமின் சுமையினால் சிறிது விலகி திரையை அடையும் என எதிர்பார்த்தனர்.[2]:104
இந்த சோதனையில் எதிர்பர்த்த மாதிரி பெரும்பாலான அல்பா துகள்கள் தங்க தகட்டை கடந்து சென்றன. ஆனால் சில அல்பா துகள்கள் அதிகமாக தனது பாதையிலிருந்து விலகி இருபதையும் மேலும் சில துகள்கள் நேர் எதிராக பிரதிபலித்து வருவதையும் கண்டனர்.[2]:104
ரூதர்போர்டு அணுமாதிரி
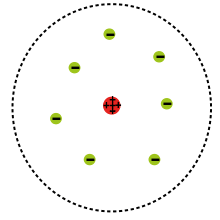
அல்பா துகள்கள் சுமார் 7000 முறை எதிர் மின் துகளை அதிக நிறை கொண்டது. இப்படிப்பட்ட அதிக நிறை கொண்ட துகள் தனது பாதையிலிருந்து விலகுவதுவும், நேர் எதிராக பிரதிபலிதும் ஒரு சிக்கலான ஒன்றாக இருந்தது. இதன் காரணமாக ரூதர்போர்டு புதிய அணுமாதிரியை முன்மொழிந்தார். அதுவே ரூதர்போர்டு அணுமாதிரி என்று அழைக்கப்பட்டது.
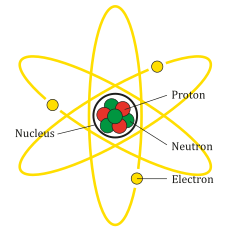
ரூதர்போர்டு அணுமாதிரிபடி அணுக்களின் மையத்தில் அணுக்கருவில் நேர்மின் சுமை குவிந்து உள்ளது. எதிர் மின் துகள்கள் சிறிது தொலைவின் இருக்கிறது என்றும் இதன் காரணமாக அணுவின் பெரும்பாலான பகுதி வெற்றிடமாகவே இருபதாகவும் சொல்லபட்டது.[2]:104 இதன் காரணமாகவே பெரும்பாலான அல்பா துகள்கள் நேராக செல்கிறது, அணுக்கருவிற்கு அருகில் செல்லும் பொழுது நேர் மின்புலத்தால் விலகியும் அல்பா துகள்கள் செல்கிறது.[2]:105
ரூதர்போர்டு அணுமாதிரி ஏற்றுக்கொள்ளும்படி இருந்தது. ஒரு அணுவில் அணுக்கருவில் நேர்மிசுமை குவிந்தும், எதிர் மின்சுமை துகள் சிறிது தொலைவிலும் இருப்பது சோதனை மூலம் நிருபிக்கப்பட்டது. இருந்த போதிலும் அணு ஒரு மின்சுமை அற்ற ஒன்றாகவே இருந்தது.[2]:118 தாம்சன் அணுமாதிரியில் எதிர் மின்துகள் புதைந்து இயக்கம் இல்லாமல் இருந்தது. ஆனால் அது போன்று ரூதர்போர்டு அணுமாதிரியில் சொல்லமுடியவில்லை. காரணம், இந்த மாதிரியில் வெற்றிடதில் எதிர் மின்துகள் இருக்கின்றன. இதனால் இத்துகள்கள் நிலையாக இருபதற்கு சாத்தியம் இல்லை. ஏனெனில் நேர்மின்சுமைகும் எதிர்மின்சுமைகும் இடையே உள்ள கவர்ச்சி அணுவின் அமைப்பை குலைத்துவிடும். அதனால் இந்த எதிர் மின்துகள் அணுகருவை சுற்றி வருவதாக கொள்ளப்பட்டது. இது கோள்கள் சூரியனை (ஞாயிறு) சுற்றுவது போன்றது.
எதிர் மின்துகள் வட்டப்பாதை
மேற்கூரியபடி ஒரு ஹைட்ரஜன் அணு ஆராய்வோம். இதில் ஒரே ஒரு எதிர் மின்துகள் (எதிர்மின்னி) உள்ளது. இந்த துகள் ஒரு வட்ட பாதையில் சுழல்வதாக கொள்வோம். இதன் மையநோக்கு விசை பின்வருமாறு:[2]:118-120
அனுகருவிற்கும் எதிர் மின்துகளுக்கும் (எதிர்மின்னி) இடையே உள்ள மின்னியல் ஈர்ப்பு பின்வருமாறு
சுற்றுபதை நிலையாக மேற்கண்ட இரண்டும் சமமாக இருக்கவேண்டும்,
எதிர் மின்துகள் திசைவேகம் "v" பின்வருமாறு,
எதிர் மின்துகளின் மொத்த ஆற்றல், அத்துகளின் இயக்க ஆற்றல் மற்றும் நிலை ஆற்றலை ஆகும்.
எனவே இயக்க ஆற்றல் பின்வருமாறு,
நிலை ஆற்றல்,
அகவே,
=
ஆனால்
எனவே
=
எதிர் மின்துகளின் ஆற்றல் இவ்வாறு இருப்பது அந்த எதிர் மின்துகளை ஒரு கட்டுபாட்டில் இருக்க வைக்கிறது.
ஒரு எதிர் மின்துகளை ஹைட்ரஜன் அணுவிலிருந்து பிரிக்க சோதனைகளின் படி 13.6 eV ஆற்றல் தேவைபடுகிறது.
எனவே 13.6 eV = ஜூல்
ஆகவே
=
இந்த சுற்றுபாதையின் ஆரம் ஏற்றுகொள்ள கூடியதாக இருந்தது.
செவ்வியல் இயற்பியலின் தோல்வி
இந்த அணு அமைப்பு மிகவும் ஏற்று கொள்ளகூடியதாக இருபினும் மின்காந்தவியல் படி எற்றுகொள்ளகூடியதாக இல்லை. இதை சிறிதே ஆராய்வோம். மின்காந்தவியல் படி உந்தப்படும் மின்துகள் ஆற்றலை வெளிவிடும் என்பதே![2]:120-121 அப்படி பார்க்கையில் இந்த வெளிவிடும் ஆற்றலை பின்வருமாறு குறிப்பிடலாம்.
இதை இவ்வாரும் எழுதலாம்,
எதிர் மின்துகளின் முடுக்கம் பின்வருமாறு,
எனவே,
ஹைட்ரஜன் அணுவின் ஆரம்
இந்த அளவு ஆற்றல் மிக அதிகம். இதன் காரணமாக எதிர் மின்துகளின் ஆற்றல் குறைந்து இறுதியில் அணுக்கருவை அடையும். இதற்கு எடுத்துகொள்ளும் காலம் நொடிகளே! ஆனால் எல்லா அணுக்களும் நிலையாக இருக்கிறது. இதனால் ரூதர்போர்டு அணுமாதிரி தோல்வி அடைந்தது. இதுவே போர் அணுமாதிரி வருவதற்கு காரணமாகியது. மேலும் பழைய இயக்கவியல் முடிவுக்கு வந்தது.
மேற்கோள்கள்
- Akhlesh Lakhtakia (Ed.); Salpeter, Edwin E. (1996). "Models and Modelers of Hydrogen". American Journal of Physics (World Scientific) 65 (9): 933. doi:10.1119/1.18691. பன்னாட்டுத் தரப்புத்தக எண்:981-02-2302-1. Bibcode: 1997AmJPh..65..933L.
- Beiser, Arthur (International Edition, 1969). Perspectives of Modern Physics. McGraw-Hill book Company.