மெய் வளிமம்
மெய் வளிமம் (real gas) என்பது கருத்தியல் நிலையிலிருந்து விலகிச் செல்லும் வளிமம் ஆகும். இவ்விலகீட்டுக்குக் குறிப்பாக இரண்டு காரணிகள் உள்ளன. 1) அழுத்தம் அதிகரிக்க அதிகரிக்க, வளிமத்தின் கன அளவு குறைந்து கொண்டே சென்று ஒரு கட்டத்தில் சுழியத்தை எட்டும் என்கிறது கருத்தியல் விதி. ஆனால், வளிம மூலக்கூறுகளின் இருப்பாலும், ஒரு கட்டத்துக்கு மேல் அமுக்க இயலாது என்பதாலும், இக்கன அளவு மிகவும் சிறியதானாலும், அது எப்போதும் சுழியமாகாது. 2) உயர் வெப்பநிலைகளில் மூலக்கூற்று இடைவிசை அதிகம் இராது என்றாலும், குறைந்த வெப்பநிலைகளில் இவ்விசை நிச்சயமாக இருக்கும்.
மெய் வளிமங்களை நன்கு புரிந்துகொள்ள, பின்வரும் கருத்துகளை அறிந்திருக்க வேண்டும்.
- அமுங்குமைத் தாக்கங்கள்;
- மாறும் தன்வெப்பக் கொண்மை;
- வான் டெர் வால்ஸ் விசை;
- சமநிலையல்லா வெப்ப இயக்கவியல் தன்மைகள்;
பெரும்பாலான பயன்பாடுகளுக்கு, கருத்தியலில் இருந்து இவ்வேறுபாடு தேவையற்ற ஒன்று என்று பொருட்படுத்தாமல் இருந்துவிடலாம். கருத்தியல் வளிமம் என்பதே போதுமானது. ஆனால், வளிமங்களின் உறைநிலை அருகிலோ, உயர் அழுத்தங்களிலோ, மாறுநிலைப் புள்ளிகளுக்கு அருகிலோ, ஜூல்-தாம்சன் விளைவு போன்றவற்றை விவரிக்கவோ, மெய் வளிமத்தைப் பயன்படுத்த வேண்டியிருக்கும். கருத்தியல் நிலையிலிருந்து விலகீட்டை அமுங்குமைக் காரணி Z கொண்டு குறிக்கலாம்.
சமன்பாடுகள்
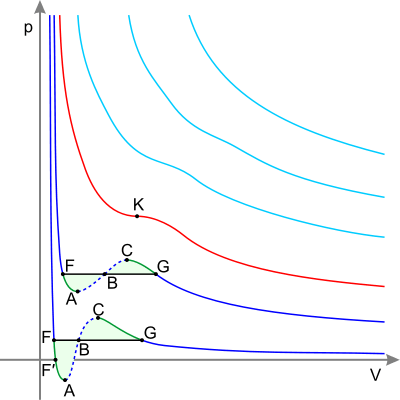
அடர்நீலம் - மாறுநிலைக்குக் கீழான சமவெப்ப ரேகைகள் பச்சை - metastable states.
F புள்ளிக்கு இடதுபுறம் - இயல்பு நீர்மம்
F புள்ளி – கொதிநிலை.
FG கோடு – ஆவி-நீர்மச் சமன்நிலை
FA பகுதி – அதிவெப்ப நீர்மம்
F′A பகுதி – stretched liquid (p<0).
AC பகுதி – analytic continuation of isotherm, physically impossible.
CG பகுதி – மீக்குளிர்வித்த ஆவி
G புள்ளி – பனி நிலை.
G புள்ளிக்கு வலதுபுறம் – வளிமம்
Red curve – மாறுநிலைச் சமவெப்ப ரேகை.
Point K – மாறுநிலைப்புள்ளி.
Light blue curves – supercritical isotherms
வெப்ப இயக்கவியல் விரிவு வேலை
மெய் வளிமங்களின் விரிவு வேலை கருத்தியல் வளிமங்களினதை விட வேறுபட்டிருக்கும். அவ்வேறுபாட்டின் அளவு:
- .
இவற்றையும் பார்க்க
- அமுங்குமை
- நிலைச் சமன்பாடு
- வளிம விதிகள்
- கருத்தியல் வளிம விதி: பாயில் விதி and கே-லூசாக் விதி
மேற்கோள்கள்
- Dilip Kondepudi, Ilya Prigogine, Modern Thermodynamics, John Wiley & Sons, 1998, ISBN 0-471-97393-9
- Hsieh, Jui Sheng, Engineering Thermodynamics, Prentice-Hall Inc., Englewood Cliffs, New Jersey 07632, 1993. ISBN 0-13-275702-8
- Stanley M. Walas, Phase Equilibria in Chemical Engineering, Butterworth Publishers, 1985. ISBN 0-409-95162-5
- M. Aznar, and A. Silva Telles, A Data Bank of Parameters for the Attractive Coefficient of the Peng–Robinson Equation of State, Braz. J. Chem. Eng. vol. 14 no. 1 São Paulo Mar. 1997, ISSN 0104-6632
- An introduction to thermodynamics by Y. V. C. Rao
- The corresponding-states principle and its practice: thermodynamic, transport and surface properties of fluids by Hong Wei Xiang