இரசாயன முனைவுத்தன்மை
ஒரு பங்கீட்டு வலு மூலக்கூற்றில் மூலக்கூற்றுக் கட்டமைப்பு காரணமாக மூலக்கூற்றில் ஏற்றங்கள் பிரிவடைந்து இரண்டு அல்லது இரண்டுக்கு மேற்பட்ட ஏற்றமுடைய பிரதேசங்கள் உருவாகின்றமை இரசாயன முனைவுத்தன்மை (Chemical polarity) எனப்படும். இருமுனைவு-இருமுனைவு இடைத்தாக்கங்கள் மூலமும் ஐதரசன் பிணைப்பு மூலமும் முனைவு மூலக்கூறுகள் இடைத்தாக்கங்களில் ஈடுபடும். மூலக்கூற்றுக் கட்டமைப்பு சமச்சீரற்றதாகவும், அணுக்களுக்கிடையில் மின்னெதிர்த்தன்மையில் வித்தியாசமுள்ளதாகவும் காணப்பட்டால், இரசாயன முனைவுத்தன்மையுள்ள முனைவாக்கப்பட்ட மூலக்கூறு உருவாகும். நாம் அன்றாடம் பயன்படுத்தும் நீர் ஒரு இரசாயன் முனைவுத்தன்மையுள்ள சேர்மமாகும். உருகு நிலை, கொதிநிலை, மேற்பரப்பு இழுவிசை, கரையுந்தன்மை போன்ற முக்கிய பௌதீகப் பண்புகளில் இரசாயன முனைவுத்தன்மை செல்வாக்கு செலுத்துகின்றது.
இரசாயன பிணைப்புகளில் முனைவாக்கம்
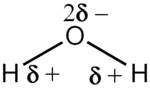
பொதுவாக சகப்பிணைப்பில் ஈடுபட்டுள்ள அணுக்களுக்கிடையில் இலத்திரன்கள் சமமாகப் பகிரப்படுவதில்லை. அதிக மின்னெதிர்த்தன்மை உள்ள அணுவிற்கருகில் அதிக இலத்திரன்களும், குறைந்த மின்னெதிர்த்தன்மை உள்ள அணுவிற்கருகில் குறைவான இலத்திரன்களும் காணப்படும். எனவே மூலக்கூற்றின் ஒரு பகுதி சிறிதளவான நேரேற்றத்தையும், மற்றைய பகுதி சிறிதளவான மறையேற்றத்தையும் கொண்டிருக்கும். இவ்வாறு இரண்டு எதிரெதிர் ஏற்றப்பகுதிகள் காணப்பட்டால் அம்மூலக்கூறு இரு முனைவு மூலக்கூறு எனப்படும். இவ்வாறு பல ஏற்றப் பிரதேசங்கள் இருந்தால் அம்மூலக்கூறு பல் முனைவு மூலக்கூறு எனப்படும்.
மூலக்கூறில் குறை நேரேற்றமுடைய பிரதேசம் δ+ எனவும் குறை மறையேற்றமுடைய பிரதேசம் δ− எனவும் குறிப்பிடப்படும்.[1]
மூலக்கூறுகளின் முனைவுத்தன்மை
முனைவுத்தன்மையுடைய மூலக்கூறுகள்
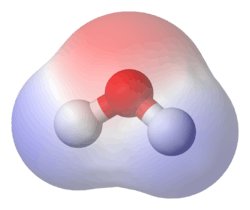
பல சேர்மங்கள் முனைவுத்தன்மையைக் காட்டுகின்றன. நீரில் (H2O) ஐதரசன் அணுக்கள் ஒவ்வொன்றும் ஒவ்வொரு குறை நேரேற்றத்தைக் கொண்டுள்ளன. ஒக்சிசன் அணு இரு குறை மறையேற்றங்களைக் கொண்டுள்ளது. இவ்வாறு நீர் முனைவுத்தன்மையைக் கொண்டிருப்பதால், முனைவுத்தன்மையுடைய பங்கீட்டு வலு சேர்மங்களும், அயன் சேர்மங்களும் இலகுவாக நீரில் கரைகின்றன. இவை இருமுனைவு-இருமுனைவு மற்றும் அயன்-இருமுனைவு இடைத்தாக்கங்களால் நீரில் இலகுவாகக் கரைகின்றன. இதனாலேயே முனைவுத்தன்மையற்ற பெட்ரோலியப் பொருட்கள் நீரில் கரைவதில்லை; அதே வேளை OH குழுக்களுடைய சீனி (சுக்ரோசு) முனைவாக்கத்தோடிருப்பதால் நீரில் கரைகின்றது.
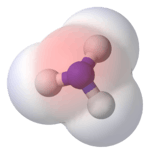
ஐதரசன் ஃபுளோரைட்டு (HF) மூலக்கூறில் அதிக மின்னெதிர்த்தன்மையுடைய ஃபுளோரின் அணுவை நோக்கி இலத்திரன்கள் செல்வதால் புளோரீன் பக்கம் குறை மறையேற்றமும், ஐதரசன் பக்கம் குறை நேரேற்றமும் உள்ளது.
அமோனியா (NH3) மூலக்கூறில் பிணைப்பில் ஈடுபடாத இரு இலத்திரன்களின் மின்னியல் விசை காரணமாக இம்மூலக்கூறின் ஒழுக்குகள் ஒரு நான்முகியின் வடிவை அடைகின்றது. அமோனியா மூலக்கூறு கூம்பக வடிவை அடைகின்றது. இவ்வடிவம் சமச்சீரற்ற வடிவமென்பதால் நைதரசனின் அதிக மின்னெதிர்த்தன்மையால் ஏற்படும் மறையேற்றம் நிவர்த்தி செய்யப்படுவதில்லை. இதனால் அமோனியா முனைவாக்கமுடைய சேர்வையாக உள்ளது.
முனைவுத்தன்மையற்ற மூலக்கூறுகள்
மூலக்கூற்றில் அணுக்களிடையே மின்னெதிர்த்தன்மையில் வித்தியாசம் காணப்பட்டாலும், அம்மூலக்கூறு சமச்சீரான மூலக்கூற்றுக் கட்டமைப்பைக் கொண்டிருந்தால், எதிரெதிரே உருவாகும் குறை மின்னேற்றங்கள் ரத்து செய்து கொள்வதால் முனைவுத்தன்மையற்ற மூலக்கூறுகளே உருவாகும்.
உதாரணமாக BF3, CH4 (மெதேன்) போன்ற மூலக்கூறுகளில் அனைத்து அச்சுகளிலும் சமச்சீரான கட்டமைப்பு இருப்பதால், இவை முனைவற்றதாக உள்ளன.

O2 மூலக்கூறில் இரு அணுக்களும் ஒரே அளவான மின்னெதிர்த்தன்மையுடன் இருப்பதால் இது போன்ற மூலக்கூறுகள் முனைவற்றவையாகும்.
மூலக்கூற்று முனைவுத்தன்மையை எதிர்வுகூறல்
சாதாரண எதிர்வுகூறலை சுருக்கமாக ஒரு அட்டவணையால் விளக்கலாம்.
| மூலக்கூற்று வாய்ப்பாடு | விளக்கம் | உதாரணம் | |
| முனைவுடையது | AB | நேரான மூலக்கூறு | CO |
|---|---|---|---|
| HAx | ஒரு தனி H உள்ள மூலக்கூறுகள் | HF | |
| AxOH | மூலக்கூற்றின் ஒரு அந்தத்தில் OH குழு காணப்படுதல் | C2H5OH | |
| OxAy | மூலக்கூற்றின் ஒரு அந்தத்தில் O அணு காணப்படுதல் | H2O | |
| NxAy | மூலக்கூற்றின் ஒரு அந்தத்தில் N அணு காணப்படுதல் | NH3 | |
| முனைவற்றவை | A2 | ஒரே தனிமத்தின் இரட்டை அணு மூலக்கூறு | O2 |
| CxAy | கரிமத்தின் அனேகமான சேர்மங்கள் | CO2 |
மேற்கோள்கள்
- The Origin of the "Delta" Symbol for Fractional Charges Jensen, William B. J. Chem. Educ. 2009, 86, 545. Link