அயனிப் பிணைப்பு
அயனிப் பிணைப்பு (இலங்கை வழக்கு: அயன் பிணைப்பு ஆங்கிலம்:Ionic bonding) என்பது ஒரு வகையான வேதிப்பிணைப்பு ஆகும். இதை மின்வலுப் பிணைப்பு அல்லது மின்மவணுப் பிணைப்பு என்றும் அழைக்கிறார்கள். ஒர் அணு மற்றோர் அணுவுக்கு ஒன்று அல்லது அதற்கு மேற்பட்ட எலக்ட்ரான்களைத் தேவைக்கேற்ப வழங்குவதால் உண்டாகும் இருவேறுவகை எதிரெதிர் மின்சுமையுள்ள அயனிகளுக்கிடையே நிலவும் மின் கவர்ச்சி விசையையே அயனிப்பிணைப்பு என்கிறோம்.
அயனிப் பிணைப்புகள் ஓர் நேர்மின் அயனிக்கும், பொதுவாக ஓர் உலோகம் (மாழை), எதிர்மின் அயனிக்கும், பொதுவாக ஓர் அலோகம் (மாழையிலி) இடையே உருவாவதாகும். தூய அல்லது முழுவதுமான அயனிப் பிணைப்பு இருக்க இயலாது: அனைத்து அயனிப் பிணைப்பு சேர்மங்களும் பல்வேறளவுகளில் சகப் பிணைப்பு (பகிர்வுப் பிணைப்பு) கொண்டுள்ளன. எனவதயனிப்பிணைப்பு என்பது சகப் பிணைப்புத் தன்மையை விட (பகிர்வுப் பிணைப்புத் தன்மையைவிட) அயனிப்பிணைப்புத் தன்மை கூடுதலாக உள்ளவை என்று கூறுவது பொருந்தும். இரு அயனிகளுக்கும் உள்ள மின்னூட்டுக்களின் வேறுபாடு கூடுதல் ஆக ஆக சகப் பிணைப்பை விட அயனிப் பிணைப்புத் தன்மை கூடுகிறது. பகுதி அயனிப் பிணைப்பாகவும் பகுதி சகப் பிணைப்பாகவும் உள்ள பிணைப்புகள் முனைவுறு சகப் பிணைப்புகள் (முனைவுறு பகிர்வுப் பிணைப்பு) என அழைக்கப்படுகின்றன.
அயனிப் பிணைப்புச் சேர்வைகளின் பண்புகள்
திடநிலையில் மின்கடத்தா அயனிச் சேர்மங்கள் உருகிய நிலையில் அல்லது கரைசல்களில் மின்கடத்தியாக விளங்குகின்றன. இவற்றிற்கு பொதுவாக உயர்ந்த உருகுநிலை இருக்கும். பெரும்பாலும் நீரில் இவை கரையும்.
உருவாக்கம்
உறுதியான இலத்திரன் நிலையமைப்பை அடைவதற்காக குறைந்தளவு மின்னெதிர்த்தன்மை உடைய அணு இலத்திரனை வெளியேற்றும் போது அயன் பிணைப்பு உருவாதல் ஆரம்பமாகின்றது. இவ்வாறு நேர் மின்னேற்றம் உடைய கற்றயன் உருவாகும். (ஏனெனில் அணு எதிர்மின்னியை/ எதிர்மின்னிகளை இழந்து விட்டதால் அணுவில் உள்ள நேர்மின்னிகளின் எண்ணிக்கை எதிர்மின்னிகளின் எண்ணிக்கையை விட அதிகமாகும்.) இவ்வாறு வெளியேற்றப்படும் இலத்திரனை மின்னெதிர்த்தன்மை அதிகமுள்ள (அனேகமாக ஒரு அல்லுலோகம்) அணுவால் ஏற்றுக்கொள்ளப்பட்டு மறை மின்னேற்றமுடைய அனயன்கள் (ஏனெனில் அணு எதிர்மின்னியை/ எதிர்மின்னிகளை ஏற்றுக்கொண்டதால் அணுவில் உள்ள எதிர்மின்னிகளின் எண்ணிக்கை நேர்மின்னிகளின் எண்ணிக்கையை விட அதிகமாகும்) உருவாக்கப்படும். இவ்வாறு எதிர்மின்னிகளை இழப்பதாலும், பெற்றுக்கொள்வதாலும் உறுதியான இலத்திரன் நிலையமைப்பை அயன் பிணைப்பில் பங்குகொள்ளும் அணுக்கள் பெற்றுக்கொள்கின்றன.
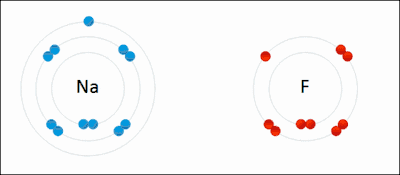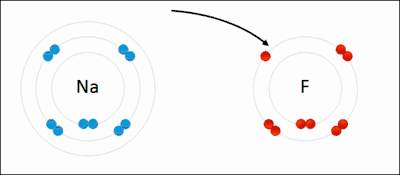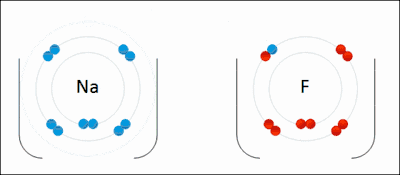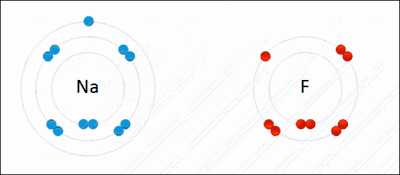
உதாரணமாக மேலே அசைவூட்டல் படத்தில் காட்டப்பட்ட அயனிப் பிணைப்பு உருவாக்கத்தை நோக்குவோம்.
- Na + F → Na+ + F− → NaF
சோடியம் (Na) என்ற உலோகம் 2,8,1 என்ற எண்ணிக்கையில் எலக்ட்ரான்களை முறையே 1,2,3 வட்டப்பாதைகளில் பெற்றுள்ளது. இது தனது 3 ஆவது வட்டப்பாதையிலுள்ள ஒரு எலக்ட்ரானை இழந்து சோடியம் நேர்மின் அயனியாக மாறுகிறது. இவ்வயனி தற்போது 2 ஆவது வட்டப்பாதையை கடைசி வட்டப்பாதையாகக் கொண்டு அதில் எட்டு எலக்ட்ரான்களைப் பெற்றிருப்பதால் நிலைப்புத் தன்மையை அடைகிறது.
புளோரின் (F) என்ற அலோகம் 2,7 என்ற எண்ணிக்கையில் எலக்ட்ரான்களை முறையே 1,2, வட்டப்பாதைகளில் பெற்றுள்ளது. சோடியம் வழங்கும் ஓர் எலக்ட்ரானை இரண்டாவது வட்டப்பாதையில் ஏற்று புளோரைடு என்னும் எதிர்மின் சுமையுடைய அயனியாக மாறுகிறது. இந்த அயனி தற்போது 2 ஆவது வட்டப்பாதையை கடைசி வட்டப்பாதையாகக் கொண்டு அதில் எட்டு எலக்ட்ரான்களைப் பெற்றிருப்பதால் நிலைப்புத் தன்மையை அடைகிறது.
இத்தகைய நிலைப்புத் தன்மையை எய்துவதற்காக சோடியம் அணு எலக்ட்ரான் வழங்கியாகவும் புளோரின் அணு எலக்ட்ரான் ஏற்பியாகவும் செயல்பட்டு முறையே நேர், எதிர் மின் சுமைகொண்ட அயனிகளாக மாற்றம் பெறுகின்றன. எதிரெதிரான மின்சுமை கொண்ட இவ்விரு அயனிகளுக்கிடையே நிலவும் நிலைமின் கவர்ச்சி அவற்றிடையே ஒரு வலுவான பிணைப்பைத் தோற்றுவிக்கின்றது. இப்பிணைப்பே அயனிப் பிணைப்பு எனப்படுகிறது.
பொதுவாக அயன் பிணைப்பு உருவாவதற்கு அயன் பிணைப்பை உருவாக்கும் அணுக்களுக்கிடையிலான மின்னெதிர்த்தன்மை வித்தியாசம் 2.1க்கும் அதிகமாக இருத்தல் வேண்டும்.