குரோமேற்று மற்றும் இருகுரோமேற்று
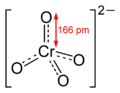
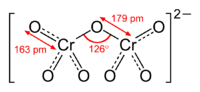
+6 ஒக்சியேற்றும் நிலையிலுள்ள குரோமியம் தனிமத்தின் இரு வகையான ஒக்சிஅன்னயன்களே குரோமேற்று மற்றும் இருகுரோமேற்றாகும். இரண்டினதும் ஏற்றம் ஒன்றென்றாலும், இரண்டும் வெவ்வேறு மூலக்கூட்டுக் கட்டமைப்புடையன. குரோமேற்று அயன் CrO42- என்ற மூலக்கூற்று வாய்ப்பாடாலும், இருகுரோமேற்று அயன் Cr2O72- என்ற மூலக்கூற்று வாய்ப்பாடாலும் குறிக்கப்படுகின்றன. குரோமேற்று அயனின் உப்புக்கள் மஞ்சள் நிறத்திலும், இருகுரோமேற்று அயனின் உப்புக்கள் செம்மஞ்சள் நிறத்திலும் உள்ளன.
| குரோமேற்று மற்றும் இருகுரோமேற்று | |||
|---|---|---|---|
குரோமேற்று மற்றும் இருகுரோமேற்று | |||
| பண்புகள் | |||
| CrO2− 4 மற்றும் Cr 2O2− 7 | |||
| வாய்ப்பாட்டு எடை | 115.994 g mol-1 மற்றும் 215.988 g mol-1 | ||
| Except where noted otherwise, data are given for materials in their standard state (at 25 °C, 100 kPa) | |||
| Infobox references | |||


இரசாயனப் பண்புகள்
குரோமேற்று ஐதரசன்பரவிக்சைட்டுடன் தாக்கமடைந்து பரவொகசைட்டு-ஒக்சைட்டு சேர்மத்தை உருவாக்குகின்றது. குரோமேற்று அன்னயனிலுள்ள ஒக்சிசன் அணுக்களை பரவொக்சைட்டு அயன்கள் பதிலீடு செய்வதே இதற்குக் காரணமாகும். அமிலத்தைன்மையான கரைசலில் நீல நிறமான குரோமியம்(VI)ஒக்சைட்டுபரவொகசைட்டை உருவாக்கலாம். எனினும் இது நிலைப்புத்தன்மை குறைவான சேர்மமாகும்.
அமில-கார தாக்கங்கள்
நீர்க்கரைசலில் குரோமேற்று அன்னயனும், இருகுரோமேற்று அன்னயனும் சமநிலையில் காணப்படுகின்றன.
- 2 CrO42− + 2 H+

நீர்க்கரைசலில் ஐதரசன்குரோமேற்று அன்னயனும் குரோமேற்று அன்னயனுடன் இரசாயன சமநிலையில் உள்ளது.
- 2HCrO4−

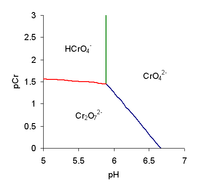
எனினும் ஒரு நீர்க்கரைசலில் மூன்று விதமான குரோமியத்தின் ஒக்சிஅன்னயன்களும் ஒரே அளவில் காணப்படுவதில்லை. கரைசலின் pH மற்றும் கணக்கிடப்பட்ட குரோமியத்தின் செறிவு [notes 1] ஆகிய காரணிகளில் குரோமேற்று, ஐதரசன்குரோமேற்று மற்றும் இருகுரோமேற்று அயன்களின் செறிவு தங்கியுள்ளது. இத்தொடர்பை இம்மூன்று அயன்களின் மேலாதிக்க வரைபு எடுத்துக்காட்டுகின்றது. வரைபில் pCr என்பது குரோமியத்தின் கணக்கீட்டுச் செறிவின் மறை லொக்காரிதமாகும். எனவே pCr=2 என்பது குரோமியத்தின் பகுத்தாய்வுச் செறிவான 10-2 mol dm-3 ஐக் குறிக்கின்றது. அமிலத்தன்மையான கரைசலில் அதிக இருகுரோமேற்று அயன்களும், நடுநிலை அல்லது கார கரைசலில் அதிகமான குரோமேற்று அயன்கள் காணப்படுவதற்கு இதுவே காரணமாகும். எனவே அமிலத்தில் குரோமேற்றுள்ள உப்பைக் கரைத்தால் அது இருகுரோமேற்றாக மாற்றமடைந்து செம்மஞ்சள் நிறத்தைக் கரைசலுக்குக் கொடுக்கும். நடுநிலையான கரைசலில் கரைத்தால் அதன் மஞ்சள் நிறத்தையே தக்க வைத்திருக்கும்.
குரோமேற்று அயனுடைய உப்புக்கள் மென்காரமாகத் தொழிற்படும். எனவே இவை புரோத்திரன்களை ஏற்றுக்கொண்டு கரைசலின் அமிலத்தன்மையைக் குறைக்கின்றன.
- HCrO4−

ஒக்சியேற்றல் மற்றும் தாழ்த்தல் பண்புகள்
குரோமேற்று மற்றும் இருகுரோமேற்று அன்னயன்கள் இலத்திரன்களை ஏற்றுக்கொண்டு (ஏனையவற்றை ஒக்சியேற்றி) குறைந்த ஒக்சியேற்றும் நிலையை அடைகின்றன. எனவே குரோமேற்று மற்றும் இருகுரோமேற்றுகள் ஓரளவுக்கு சிறந்த ஒக்சியேற்றும் பொருட்களாகும். எனவே ஒக்சியேற்றப்படக்கூடிய பொருட்கள் கரைசலில் காணப்பட்டால் குரோமேற்று அல்லது இருகுரோமேற்று தாழ்த்தப்பட்டு Cr3+ அயன்களைத் தோற்றுவிக்கின்றது.
- Cr2O72− + 14 H3O+ + 6 e− → 2 Cr3+ + 21 H2O (ε0 = 1.33 V)
காரக்கரைசலில் குரோமேற்று குரோமியம் ஐதரொக்சைட்டைத் தோற்றுவிக்கின்றது. இதன் குறைந்த வோல்ட்டளவு குரோமேற்று மற்றும் இருகுரோமேற்று காரக்கரைசலில் பலங்குன்றிய ஒக்சியேற்றும் பொருட்கள் எனக் காட்டுகின்றது.
- CrO42- + 4 H
2O + 3 e- → Cr(OH)
3 + 5OH- (ε0 = −0.13 V)
பயன்பாடு

- குரோமியப் பூச்சு பூசப்படும் போது பயன்படுத்தப்படுகின்றது. உலோகங்களை அரிப்பிலிருந்து பாதுகாக்க குரோமியம் பூசப்படுகின்றது.
- குரோமேற்றுக்கள் பொதுவாக நீரில் இலகுவாகக் கரைந்தாலும், பெரிய அணுவெண்ணுடைய பார உலோகங்களின் குரோமேற்று உப்புகள் நீரில் கரைய மாட்டா. எனவே பார உலோகங்களின் குரோமேற்று உப்புகள் மஞ்சள் நிறப்பூச்சாகப் பயன்படுகின்றது.
உற்பத்தி
இரும்பு குரோமைட்டிலிருந்து குரோமேற்று உப்புக்கள் உற்பத்தி செய்யப்படுகின்றன. இரும்புகுரோமைட்டை சோடியம் காபனேற்று மற்றும் கல்சியம் காபனேற்றுடன் வளியுடன் கடும் வெப்பத்துக்கு உட்படுத்துவதால், குரோமியம் +6 ஒக்சியேற்றும் நிலைக்கு ஒக்சியேற்றப்படுவதுடன், இரும்பு ஒக்சைட்டும் தோற்றுவிக்கப்படுகின்றது.
- 4 FeCr2O4 + 8 Na2CO3 + 7 O2 → 8 Na2CrO4 + 2Fe2O3 + 8 CO2
நச்சுத்தன்மை
அதிகமான ஒக்சியேற்றும் ஆற்றல் காரணமாக குரோமேற்று மற்றும் இருகுரோமேற்றுகள் நச்சுத்தன்மையுடைய சேர்மங்களாகும். காற்றில் கலந்துள்ள குரோமேற்றுத் துகள்கள் புற்றுநோயையும் உருவாக்கலாம். எனவே இவை உள்ள பதார்த்தங்களைப் பயன்படுத்துவதைத் தவிர்த்தல் சிறந்ததாகும்.
குறிப்புகள்
- வரைபில் pCr என்பது குரோமியத்தின் கணக்கீட்டுச் செறிவின் மறை லொக்காரிதமாகும். எனவே pCr=2 என்பது குரோமியத்தின் பகுத்தாய்வுச் செறிவான 10-2 mol dm-3 ஐக் குறிக்கின்றது