নাইট্রিক অ্যাসিড
নাইট্রিক এসিড যার রাসায়নিক সংকেত HNO3, যা একুয়া ফর্টিস এবং স্পিরিট অফ নাইটার নামে পরিচিত, একটি সক্রিয় খনিজ এসিড। যৌগটি বিশুদ্ধ অবস্থায় বর্ণহীন, পুরাতন এসিড হলুদাভ রঙ ধারণ করে কারণ এটা ভেঙে নাইট্রোজেনের অক্সাইড এবং জল তৈরি করে। বাণিজ্যিক ভাবে উৎপন্ন নাইট্রিক এসিডের ঘনত্ব ৬৮%। যখন নাইট্রিক এসিডের ঘনত্ব ৮৬% এর বেশি হয় তখন একে "'ধূমায়িত নাইট্রিক অ্যাসিড "' বলে। নাইট্রোজেন ডাই অক্সাইডের উপস্থিতির ভিত্তিতে ধূমায়িত নাইট্রিক এসিড সাদা এবং লাল দুই ভাগে ভাগ করা হয়। ৯৫% এর বেশি ঘনত্বের নাইট্রিক এসিড নাইট্রেশান বিক্রিয়ার প্রধান রিএজেন্ট হিসেবে ব্যবহৃত হয়। নাইট্রিক এসিড সাধারণত দৃঢ় জারন উপাদান হিসেবে ব্যবহৃত হয়।
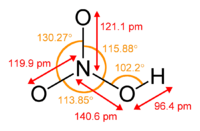 | |
| নামসমূহ | |
|---|---|
| ইউপ্যাক নাম
Nitric acid | |
| অন্যান্য নাম
Aqua fortis, Spirit of niter, Eau forte, Hydrogen nitrate, Acidum nitricum | |
| শনাক্তকারী | |
সিএএস নম্বর |
|
ত্রিমাত্রিক মডেল (জেমল) |
|
| থ্রিডিমেট | {{{value}}} |
| সিএইচইবিআই | |
| সিএইচইএমবিএল | |
| কেমস্পাইডার | |
| ইসিএইচএ ইনফোকার্ড | ১০০.০২৮.৮৩২ |
| ইসি-নম্বর | 231-714-2 |
| মেলিন রেফারেন্স | 1576 |
| কেইজিজি | |
| এমইএসএইচ | {{{value}}} |
পাবকেম CID |
|
| আরটিইসিএস নম্বর | QU5775000 |
| ইউএনআইআই | |
| ইউএন নম্বর | 2031 |
ইনকি
| |
এসএমআইএলইএস
| |
| বৈশিষ্ট্য | |
| HNO3 | |
| আণবিক ভর | ৬৩.০১ g·mol−১ |
| বর্ণ | Colorless, yellow or red fuming liquid[1] |
| গন্ধ | acrid, suffocating[1] |
| ঘনত্ব | 1.5129 g cm−3 |
| গলনাঙ্ক | −৪২ °সে (−৪৪ °ফা; ২৩১ K) |
| স্ফুটনাঙ্ক | ৮৩ °সে (১৮১ °ফা; ৩৫৬ K) 68% solution boils at ১২১ °সে (২৫০ °ফা; ৩৯৪ K) |
পানিতে দ্রাব্যতা |
Completely miscible |
| বাষ্প চাপ | 48 mmHg (20 °C)[1] |
| অম্লতা (pKa) | -1.4[2] |
| প্রতিসরাঙ্ক (nD) | 1.397 (16.5 °C) |
| ডায়াপল মুহূর্ত | 2.17 ± 0.02 D |
| তাপ রসায়নবিদ্যা | |
| স্ট্যন্ডার্ড মোলার এন্ট্রোফি এস |
146 J·mol−1·K−1[3] |
| গঠনে প্রমান এনথ্যাল্পির পরিবর্তন ΔfH |
−207 kJ·mol−1[3] |
| ঝুঁকি প্রবণতা | |
| নিরাপত্তা তথ্য শীট | ICSC 0183 PCTL Safety Website |
ইইউ শ্রেণীবিভাগ (ডিএসডি) |
|
| আর-বাক্যাংশ | আর৮ আর৩৫ |
| এস-বাক্যাংশ | (এস১/২) এস২৩ এস২৬ এস৩৬ এস৪৫ |
| এনএফপিএ ৭০৪ | 
0
4
0 OX |
| ফ্ল্যাশ পয়েন্ট | Non-flammable |
| প্রাণঘাতী ডোজ বা একাগ্রতা (LD, LC): | |
LC৫০ (মধ্যমা একাগ্রতা) |
138 ppm (rat, 30 min)[1] |
| যুক্তরাষ্ট্রের স্বাস্থ্য অনাবৃতকরণ সীমা (NIOSH): | |
PEL (অনুমোদনযোগ্য) |
TWA 2 ppm (5 mg/m3)[1] |
REL (সুপারিশকৃত) |
TWA 2 ppm (5 mg/m3) ST 4 ppm (10 mg/m3)[1] |
IDLH (তাৎক্ষণিক বিপদ |
25 ppm[1] |
| সম্পর্কিত যৌগ | |
অন্যান্য অ্যানায়নসমূহ |
Nitrous acid |
অন্যান্য ক্যাটায়নসমূহ |
Sodium nitrate Potassium nitrate Ammonium nitrate |
সম্পর্কিত যৌগ |
Dinitrogen pentoxide |
সুনির্দিষ্টভাবে উল্লেখ করা ছাড়া, পদার্থসমূহের সকল তথ্য-উপাত্তসমূহ তাদের প্রমাণ অবস্থা (২৫ °সে (৭৭ °ফা), ১০০ kPa) অনুসারে দেওয়া হয়েছে। | |
| তথ্যছক তথ্যসূত্র | |
ইতিহাস
বিজ্ঞানী জাবির ইবনে হাইয়ান সর্ব প্রথম নাইট্রিক এসিড তৈরী করেন।
উৎপাদন
নাইট্রোজেন অক্সাইডের (NO2) সাথে পানির বিক্রিয়ায় নাইট্রিক এসিড তৈরী হয়।
- 3 NO2 + H2O → 2 HNO3 + NO
সাধারণত এই বিক্রিয়ার মাধ্যমে উৎপাদিত নাইট্রিক অক্সাইড পুনরায় বাতাসের অক্সিজেন দ্বারা জারিত হয়ে নাইট্রোজেন ডাই অক্সাইড তৈরি করে।
হাইড্রোজেন পার অক্সাইড এর মধ্যে নাইট্রোজেন চালনা করলে এসিড উৎপন্ন হয়।
- 2 NO2 + H2O2 → 2 HNO3
বাণিজ্যিক নাইট্রিক এসিড দ্রবণে ৫২%-৬৮% নাইট্রিক এসিড থাকে। জার্মান রসায়নবিদ উইলহেলম অস্টওয়াল্ডের নামানুসারে নাইট্রিক এসিড উৎপাদন প্রক্রিয়াকে বলা হয় অস্টওয়াল্ড প্রক্রিয়া। এই প্রক্রিয়ায় অনাদ্র এমোনিয়া প্লাটিনাম অথবা রোডিয়াম গজ প্রভাবকের এর উপস্থিতিতে ৫০০K তাপ ও ৯bar চাপে জারিতে হয়ে নাইট্রিক অক্সাইড তৈরি করে।
- 4 NH3 (g) + 5 O2 (g) → 4 NO (g) + 6 H2O (g) (ΔH = −905.2 kJ)
নাইট্রিক অক্সাইডে এরপর বাতাসের অক্সিজেনের সাথে বিক্রিয়া করে নাইট্রোজেন ডাই অক্সাইড তৈরি করে।
- 2 NO (g) + O2 (g) → 2 NO2 (g) (ΔH = −114 kJ/mol)
এটা পানি শোষণ যুগপৎ ভাবে নাইট্রিক এসিড ও নাইট্রিক অক্সাইড তৈরি করে।
- 3 NO2 (g) + H2O (l) → 2 HNO3 (aq) + NO (g) (ΔH = −117 kJ/mol)
নাইট্রিক অক্সাইড পুনরায় চক্রে ফিরে এসে নাইট্রিক এসিডে পরিণত হয়।
- 4 NO2 (g) + O2 (g) + 2 H2O (l) → 4 HNO3 (aq)
জলীয় HNO3 কে পাতনের মাধ্যমে ৬৮% গাঢ় নাইট্রিক এসিডে রূপান্তরিত করা যায়। গাঢ় H2SO4 এর সাথে জলবিয়োজনে ৯৮% গাঢ় নাইট্রিক এসিড পাওয়া যায়।
ব্যবহার
- সার কারখানায়।
- নইট্রোগ্লিসারিন, TNT etc, বিস্ফোরক পদার্থ প্রস্তুতিতে।
- খনি হতে মূল্যবান ধাতু।
- সোনা আহরণে।
- রকেট জ্বালানিতে।
- বৈদ্যুতিক সেল তৈরিতে।
- সেলুলয়েড, কৃত্রিম রং, কৃত্রিম সিল্ক প্রস্তুতিতে।
তথ্যকোষ
- "NIOSH Pocket Guide to Chemical Hazards #0447" (ইংরেজি ভাষায়)। ন্যাশনাল ইনস্টিটিউট ফর অকুপেশনাল সেফটি অ্যান্ড হেলথ (NIOSH)।
- Bell, R. P. (১৯৭৩), The Proton in Chemistry (2nd সংস্করণ), Ithaca, NY: Cornell University Press
- Zumdahl, Steven S. (২০০৯)। Chemical Principles 6th Ed.। Houghton Mifflin Company। পৃষ্ঠা A22। আইএসবিএন 0-618-94690-X।
বহিঃসংযোগ
- NIOSH Pocket Guide to Chemical Hazards
- National Pollutant Inventory – Nitric Acid Fact Sheet
- Calculators: surface tensions, and densities, molarities and molalities of aqueous nitric acid