அரீனியசுச் சமன்பாடு
அரீனியசுச் சமன்பாடு (Arrhenius equation) என்பது வேதிவினைவேகத்தின் வெப்பநிலைச் சார்பைக் காட்டும் ஒரு வாய்பாடு ஆகும். யாக்கோபு என்றிக்கசு வான் தாஃபு என்னும் டச்சுக்காரரின் 1884ஆம் ஆண்டுப் பணியை ஒட்டி, 1889-இல் அரீனியசு இதனை முன்மொழிந்தார். இச்சமன்பாட்டிற்கு வினைவேகவியலிலும், செயலூக்க ஆற்றல் கணக்கிடவும் பெரும் பங்குண்டு.[1][2][3]
வரலாற்றடிப்படையில் பொதுவான கருத்தாகச் சொன்னால், அறைவெப்பத்தில் நிகழும் பரவலான சில வேதி வினைகளில், வெப்பநிலையில் ஒவ்வொரு 10 பாகை செல்சியசு அதிகரிப்பிற்கும், வினைவேகமானது இரட்டிக்கும்.[4]
சமன்பாடு
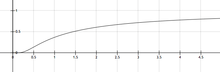
அரீனியசுச் சமன்பாட்டின் அடிப்படையில், வெப்பநிலை அதிகரிக்க அதிகரிக்க வினை வேக மாறிலியும் அதிகரிக்கும்.
- k - வினைவேக மாறிலி
- T - வெப்பநிலை (கெல்வின்)
- A - அதிர்வு காரணி
- Ea - செயலூக்க ஆற்றல்
- R - வளிம மாறிலி:[1][2][3]
இச்சமன்பாட்டைக் கீழ்க்கண்டவாறும் எழுதலாம்.
- k - வினைவேக மாறிலி
- T - வெப்பநிலை (கெல்வின்)
- A - அதிர்வு காரணி
- Ea - செயலூக்க ஆற்றல்
- kB - போல்ட்சுமான் மாறிலி
மேற்கோள்கள்
- Arrhenius, S.A. (1889). "Über die Dissociationswärme und den Einfluß der Temperatur auf den Dissociationsgrad der Elektrolyte". Z. Phys. Chem. 4: 96–116. doi:10.1515/zpch-1889-0108.
- Arrhenius, S.A. (1889). "Über die Reaktionsgeschwindigkeit bei der Inversion von Rohrzucker durch Säuren". ibid. 4: 226–248.
- Laidler, K. J. (1987) Chemical Kinetics,Third Edition, Harper & Row, p.42
- Pauling, L.C. (1988) General Chemistry, Dover Publications
This article is issued from
Wikipedia.
The text is licensed under Creative
Commons - Attribution - Sharealike.
Additional terms may apply for the media files.