சிலிக்கேட்டு
சிலிக்கேட்டு (Silicate) என்பது (SiO44-) என்ற எதிர்மின் அயனியைக் கொண்டுள்ள ஒரு சிலிக்கன் சேர்மமாகும். சிலிக்கேட்டுகளில் பெரும்பாலானவை ஆக்சைடுகளாகும். ஆனால் எக்சாபுளோரோசிலிக்கேட்டு ([SiF6]2−) போன்ற ஆக்சிசனைக் கொண்டிராத மற்ற எதிர்மின் அயனிச் சேர்மங்களும் சிலிக்கேட்டாகக் கருதப்படுகின்றன.
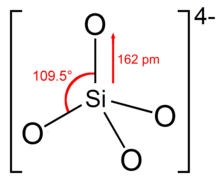
ஆர்த்தோசிலிக்கேட்டு என்பது SiO4−
4 என்ற அயனியாகும். இதை சிலிக்கன் டெட்ராக்சைடு என்ற பெயராலும் அழைக்கிறார்கள். இந்த அயனியின் பெயரையே சுருக்கமாக சிலிக்கேட்டு என்கிறார்கள். ஆர்த்தோசிலிக்கேட்டுகள் என்ற எதிர்மின் அயனிகளின் குடும்பம் அல்லது அவற்றின் சேர்மங்கள் [SiO2+n]2n−என்ற பொதுவாய்ப்பாட்டைக் கொண்டுள்ளன. வளைய மற்றும் ஒற்றைச் சங்கிலி சிலிக்கேட்டுகள் {[SiO3]2−}n மற்றும் தகடுகளாக உருவாகும் சிலிக்கேட்டுகள் {[SiO2.5]−}n. போன்றவை இக்குழுவின் முக்கியமான உறுப்பினர்களாகும் [1].
பூமியின் மேற்புறத்தில் பெரும்பான்மையும் சிலிக்கேட்டுகளால் ஆக்கப்பட்டதாகும். இது தவிர கோள்கள், சிறுகிரகங்கள், நிலவுப்பாறைகள், மற்றும் எரிமலைகள் போன்றவையும் சிலிக்கேட்டுகளேயாகும். மணல், சிமெண்ட்டு மற்றும் ஆயிரக்கணக்கான கனிமங்களும் சிலிக்கேட்டுக்கு உதாரணங்களாகும். சிலிக்கேட்டு எதிர்மின் அயனிகளை கொண்டுள்ள சிலிக்கேட்டு கனிமங்கள் உட்பட்ட சிலிக்கேட்டு சேர்மங்களின் எதிர்மின் சுமையானது பல்வேறு நேர்மின் அயனிகளால் சமப்படுத்தப்படுகிறது. எண்ணற்ற சிலிக்கேட்டுகள் தோன்ற இயலும். அவை ஒவ்வொன்றும் வெவ்வேறு நேர்மின் அயனிகளுடன் சேர்ந்து சேர்மங்களாக உருவாகின்றன. எனவே இவ்வகைப்பாட்டில் கனிமங்கள் செயற்கைப் பொருட்கள் என ஏராளமான சேர்மங்கள் காணப்படுகின்றன.
கட்டமைப்புக் கொள்கைகள்
பரவலாக சிலிக்கேட்டுகள் மற்றும் சிலிக்கேட்டு கனிமங்களில் நான்கு ஆக்சிசன் மையங்களால் சூழப்பட்டு சிலிக்கன் நாற்கோண சூழலை ஆக்ரமித்துள்ளது. இக்கட்டமைப்புகளில் சிலிக்கனின் வேதிப் பிணைப்புகள் எண்ம விதியை உறுதி செய்கின்றன. இந்த நாற்கோணம் சில சமயங்களில் SiO4−4 மையங்களாக தனிமைப்படுத்தப்படுகின்றன. ஆனால் மிகப் பொதுவாக இந்த நாற்கோணங்கள் இணைகளாகவும் (Si2O6−7) வளையங்களாகவும் (Si6O12−18) பல்வேறு முறைகளில் இணைந்திருக்கின்றன. பொதுவாக சிலிக்கேட்டு எதிர்மின் அயனிகள் சங்கிலிகள், இரட்டைச் சங்கிலிகள், தகடுகள் மற்றும் முப்பரிமாண கட்டமைப்புகள் வடிவில் காணப்படுவது வழக்கமாகும். சாதாரண வெப்பநிலைகளில் அனைத்து சிலிக்கேட்டுகளும் மிகக் குறைவான அளவில் நீரில் கரைவனவாக உள்ளன.
கரைசல்களில் சிலிக்கேட்டுகள்
சிலிக்கேட்டுகள் யாவும் திண்மங்கள் என்று தெளிவாக வரையறை செய்யப்பட்டுள்ளது. அதனால் கரைசல்களில் தென்படுவது மிகக் குறைவாக காணப்படுகிறது. SiO4−4 எதிர்மின் அயனி சிலிசிக் அமிலத்தின் (Si(OH)4) இணை காரணமாகும். இவை இரண்டும் இடைநிலை இனங்களில் தோற்றம் பெறுவது மழுப்பலாக இருக்கிறது. கரைசல்களுக்குப் பதிலாக சிலிக்கேட்டுகள் வழக்கமாக அமுக்கப்பட்ட, பகுதியாக புரோட்டானேற்றம் செய்யப்பட்ட சிலிக்கேட்டு தொகுதிக் கலவைகளாக இருப்பதை அறியமுடிகிறது. கரையும் சிலிக்கேட்டுகளின் இயற்பியல் தன்மை உயிரியகனிமப்படுத்தலையும், சியோலைட்டுகள் எனப்படும் அலுமினோசிலிக்கேட்டுகளைத் தொகுப்பதையும் புரிந்துகொள்ள பொருத்தமானதாக இருக்கிறது [2].
நாற்கோணமல்லாத சிலிக்கேட்டுகள்
சிலிக்கன் சேர்மங்கள் வழக்கமாக நாற்கோணக ஒருங்கிணைப்பு வடிவியலைப் பெற்றுள்ளன என்றாலும் சிலிக்கன் அதைவிட அதிகமான ஒருங்கிணைவு எண்களை ஏற்கத்தக்கது என்பது நன்கு அறியப்பட்டதேயாகும். இதற்கு நன்கு அறியப்பட்ட உதாரணமாக இருப்பது எக்சாபுளோரோசிலிக்கேட்டு (SiF2−6) ஆகும். எண்கோண ஒருங்கிணைப்பில் ஆறு ஆக்சிசன் மையங்கள் அறியப்படுகின்றன. மிக உயர்ந்த அழுத்தத்தில் SiO2 சேர்மமும் கூட அதனுடைய கனிமமான சிடிசோவைட்டில் இவ்வடிவத்தை ஏற்கிறது.
சிலிக்கேட்டுப் பாறைகளும் கனிமங்களும்
நிலவியல் மற்றும் வானவியலில் சிலிக்கேட்டு என்ற சொல் சில வகையான பாறை வகைகளையும் குறிப்பாக சிலிக்கேட்டு கனிமங்களையும் குறிக்கவே பயன்படுகிறது. பூமியின் மேலோட்டில் பலவிதமான சிலிக்கேட் தாதுக்கள் புவி மேற்பரப்பை உருவாக்கும் மற்றும் புதுப்பிக்கும் செயல்முறையில் பரவலான கலவைகளில் உருவாகின்றன, பகுதியாக உருவாக்கம், படிகமாதல், பகுதியாதல், பல் உருவமாதல் போன்ற செயல்பாடுகள் இதிலடங்கும். வாழும் உயிரினங்களும் புவியில் சிலிக்கேட்டுச் சுழற்சிக்கு பெரிதும் உதவுகின்றன. சிலிக்கா அல்லது சிலிக்கன் டை ஆக்சைடும் சில சமயங்களில் சிலிக்கேட்டு என்றழைக்கப்படுகிறது. இயற்கையில் குவாட்சு கனிமத்தில் சிலிக்கா காணப்படுகிறது.
மேற்கோள்கள்
- Greenwood, Norman N.; Earnshaw, Alan (1997). Chemistry of the Elements (2nd ). Butterworth–Heinemann. பன்னாட்டுத் தரப்புத்தக எண்:0080379419.
- Knight, Christopher T. G.; Balec, Raymond J.; Kinrade, Stephen D. (2007). "The Structure of Silicate Anions in Aqueous Alkaline Solutions". Angewandte Chemie International Edition 46: 8148–8152. doi:10.1002/anie.200702986.