ஈரியல்பு (வேதியியல்)
இரசாயனவியலில் ஒரு மூலக்கூறு அமிலமாகவும் காரமாகவும் செயற்படக்கூடிய இயல்பே ஈரியல்பு (Amphoterism) எனப்படுகின்றது. பல உலோகங்கள் ஈரியல்புள்ள ஒக்சைட்டுகளை உருவாக்குகின்றன. நாகம், வெள்ளீயம், ஈயம், அலுமினியம், பெரிலியம் ஆகிய உலோகங்களின் ஒக்சைட்டுகள் ஈரியல்புள்ள பதார்த்தங்களுக்கு உதாரணங்களாகும். இவ்வீரியல்பு ஒக்சைட்டின் ஒக்சியேற்றும் நிலையில் தங்கியுள்ளது. ஈரியல்புப் பதார்த்தங்களில் ஒக்சைட்டுகள் மாத்திரமல்லாமல் H+ அயன்களை ஏற்றுக்கொள்ளக்கூடிய மற்றும் வழங்கக்கூடிய பல மூலக்கூறுகளும் அடங்குகின்றன. இவற்றிற்கு புரதங்களும் அமினோவமிலங்களும் சிறந்த உதாரணங்களாகும். இவற்றிலுள்ள காபொக்சைல் செயற்பாட்டுக் குழு H+ அயனை வழங்கும், அமைன் குழு H+ அயனை ஏற்றுக்கொள்ளும். நீர் மற்றும் அமோனியா போன்ற தானாக அயனாக்கமடையும் முனைவாக்கமுடைய மூலக்கூறுகளும் ஈரியல்பைக் காட்டுகின்றன.
| காடிகளும் காரங்களும் |
|---|
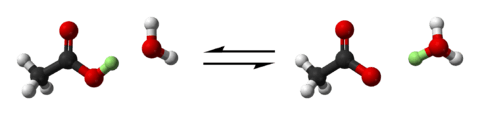 |
|
| காடியின் வகைகள் |
|
| கார வகைகள் |
|
ஈரியல்புள்ள ஒக்சைட்டுகளும், ஐதரொக்சைட்டுகளும்
அமிலம், காரம் இரண்டுடனும் நாக ஒக்சைட்டு (ZnO) தாக்கமடையக்கூடியது:
- அமிலத்தில்: ZnO + 2H+ → Zn2+ + H2O
- காரத்தில்: ZnO + H2O + 2 OH- → [Zn(OH)4]2-
அலுமினியம் ஐதரொக்சைட்டும் ஈரியல்புள்ளதாகும் (சுருக்கப்பட்ட தாக்கம்)
- காரமாக ஒரு அமிலத்தை நடுநிலையாக்கல்: Al(OH)3 + 3 HCl → AlCl3 + 3 H2O
- அமிலமாக ஒரு காரத்தை நடுநிலையாக்கல்: Al(OH)3 + NaOH → Na[Al(OH)4]
வேறு சில ஈரியல்புச் சேர்மங்கள்:
- பெரிலியம் ஐதரொக்சைட்டு
- அமிலத்துடன் தாக்கம்: Be(OH)2 + 2 HCl → BeCl2 + 2 H2O
- காரத்துடன் தாக்கம்: Be(OH)2 + 2 NaOH → Na2[Be(OH)4]
- அலுமினியம் ஒக்சைட்டு
- அமிலத்துடன் தாக்கம்: Al2O3 + 3 H2O + 6 H3O+(aq) → 2 [Al(H2O)6]3+(aq)
- காரத்துடன் தாக்கம்: Al2O3 + 3 H2O + 2 OH-(aq) → 2 [Al(OH)4]-(aq)
- ஈய(II)ஒக்சைட்டு
- அமிலத்துடன் தாக்கம்: PbO + 2 HCl → PbCl2 + H2O
- காரத்துடன் தாக்கம்: PbO + 2 NaOH + H2O → Na2[Pb(OH)4]
ஈரியல்புள்ள மூலக்கூறுகள்
புரொன்ஸ்டட்-லௌரி கொள்கையின் படி அமிலங்கள் நேர்மின்னி வழங்குனராகவும், காரங்கள் நேர்மின்னியை ஏற்றுக்கொள்பனவாகவும் தொழிற்படுகின்றன. ஆனால் அமிலத்தன்மைக்கும், காரத்தன்மைக்கும் இடைப்பட்ட ஈரியல்புள்ள பதார்த்தங்கள் நேர்மின்னியை (அல்லது ஐதரசன் அயன்) சில சந்தர்ப்பத்தில் வழங்குகின்றன; சில சந்தர்ப்பத்தில் ஏற்றுக்கொள்கின்றன. நீர், அமோனியா, அமினோ அமிலங்கள், HCO3- மற்றும் HSO4- அயன்கள் ஈரியல்பைக் காட்டும் மூலக்கூறுகளாகும்.
ஐதரசன் காபனேற்று (அல்லது இருகாபனேற்று) அயன் காரமாக செயற்படலாம்:
- HCO3- + H3O+ → H2CO3 + H2O
அது அமிலமாகவும் செயற்படலாம்:
- HCO3- + OH- → CO32- + H2O
ஐதரசன் குளோரைட்டு போன்ற அமிலங்களுடன் தாக்கமடையும் போது நீர் காரமாகச் செயற்படும் இயல்புடையது:
- H2O + HCl → H3O+ + Cl-,
அமோனியா போன்ற மென்காரத்தோடு தாக்கமடையும் போது நீர் அமிலமாகச் செயற்படுகின்றது:
- H2O + NH3 → NH4+ + OH-